
- •Л.С.Сухорукова, т.І.Курова, н.І.Мальцева, в.І.Григор’єва,
- •Основи загальної хімії Навчальний посібник
- •Атомно-молекулярне вчення
- •Основні закономірності перебігу хімічних реакцій
- •Розчини. Дисперсні системи
- •Молярна концентрація еквівалента або нормальність (сн) визначається
- •Основи дисоціюють з утворенням катіонів металу і гідроксид-іонів он-:
- •Наприклад, дисоціацію такого індикатора як лакмус, можна описати рівнянням
- •Властивості деяких кислотно-основних індикаторів
- •Ступінь гідролізу визначається співвідношенням:
- •Класифікація дисперсних систем за агрегатним станом дисперсної фази та дисперсійного середовища
- •Зміна механічних властивостей гелю кремнієвої кислоти h2SiO3 при обезводненні
- •Будова речовини
- •Головна підгрупа Побічна група
- •Двох періодів
- •Відносні електронегативності елементів(за шкалою Полінга)
- •2 Відштовхування rзв. Е, кДж/моль
- •Окисно-відновні реакції. Основи електрохімії
- •5.3. Корозія металів. Методи захисту металів від корозії
- •1. Якщо в розчині присутні аніони безкисневих кислот s2-,I-,Br-,Cl- (крім f-) або іони , то відбувається окиснення цих аніонів у послідовності:
- •Неметали
- •Неорганічні в'яжучі речовини
- •Приблизний мінералогічний склад портландцементного клінкеру
- •Характеристики процесів гідратації та продуктів твердіння складових портландцементу
- •Органічні сполуки
- •Найважливіші класи органічних сполук
- •Органічні полімерні матеріали в будівництві
- •Xімія та екологія
1. Якщо в розчині присутні аніони безкисневих кислот s2-,I-,Br-,Cl- (крім f-) або іони , то відбувається окиснення цих аніонів у послідовності:
![]() ,
,
тобто в першу чергу розряджаються ті іони, які мають менше значення по-тенціалу;
2. Якщо в розчині вказані аніони відсутні, то молекули води розряджаються за схемою:
2H2O-2eO2+4H+.
З
аніонами кисневмісних кислот, наприклад,
![]() і
т. ін., крім особливих випадків, ніяких
перетворень не відбувається.
і
т. ін., крім особливих випадків, ніяких
перетворень не відбувається.
У випадку розчинних анодів відбувається розчинення металу, з якого виготовлений анод (якщо стандартний електродний потенціал цього металу менший за стандартний потенціал кисневого електрода, тобто 1,23 В):
![]() .
.
Розчинними анодами, які безпосередньо беруть участь в електролізі, можуть бути: мідь, нікель, цинк, срібло та ін. При цьому виді електролізу анод (метал) окиснюється (розчиняється), катіони металу, що утворюються, переміщуються до катода і відновлюються на ньому до металу . Таким чином, метал розчинного анода осідає на катоді.
Розглянемо кілька прикладів електролізу водних розчинів електролітів з нерозчинним і розчинним анодами.
Приклад 1. Електроліз водного розчину хлориду міді (II) з графітовими електродами:
![]() ;
;
![]() ;
;
![]() .
.
Приклад 2. Електроліз водного розчину сульфату нікелю (II ) з інертним анодом:
![]() ;
;
![]() 2H2O+2eH2+2OH-;
2H2O+2eH2+2OH-;
![]() .
.
Приклад 3. Електроліз водного розчину нітрату цинку з розчинним цинковим анодом:
![]() ;
;
![]() ;
;
![]() .
.
Кількісні характеристики електрохімічних процесів описуються зако-ном Фарадея: маса речовини, що виділяється на електродах під час електро-лізу, пропорційна кількості електрики,що проходить через розчин і не залежить від інших факторів. Маса речовини, яка виділяється при проходженні I Кл електрики, дорівнює молярній масі електрохімічного еквівалента.
Математичний вираз об’єднаного закону Фарадея:
![]() ,
,
де m — маса окисненої або відновленої речовини, г.
ME — молярна маса еквівалента речовини, г/моль,
I — сила струму, А;
t — час, с. ;
F — стала Фарадея.
Електроліз знаходить широке застосування в багатьох галузях про-мисловості.
Розділ 6.
МЕТАЛИ
6.1. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
Із відомих 110 хімічних елементів 88 є металами. До елементів–металів належать s–елементи І і ІІ груп, усі d- і f-елементи, а також р-елементи голов-них підгруп: ІІІ( крім В), ІV( Ge,Sn,Pb), V(Sb,Bi) і VI( Pо) груп.
Атоми металів, як правило, мають у зовнішньому електронному шарі 1,2 і
значно рідше 3 або 4 електрони.
Метали визначаються здатністю їхніх атомів легко віддавати свої вален-тні електрони і перетворюватися на позитивні іони внаслідок низьких значень електронегативностей, які обумовлені невисокими енергіями іонізації атомів і невеликою ( часто від’ємною) спорідненістю до електрона.
Метали як прості речовини. Елементи-метали утворюють прості речовини тієї ж назви. За звичайних умов це тверді речовини кристалічної будови (крім ртуті ) з металічним типом зв’язку (див.р.4.3.). Кристалічні решітки металів складаються з нейтральних атомів і позитивних іонів, які оточені вільними електронами. Рух електронів відбувається хаотично, подібно до руху молекул газу (рис. 26).
Рис. 26. Схематичне зображення металевих
решіток
Хімічні властивості металів. Метали як відновники взаємодіють з окисниками, наприклад, з киснем, галогенами, сіркою, азотом, фосфором. Лужні та лужноземельні метали взаємодіють також з воднем:
t
2Cu+O2 2CuO;
t
2Na+Cl2 2NaCl;
t
2Al+3S Al2S3;
3Mg+N2 Mg3N2;
3Ca+2P Ca3P2;
2Na+H2 2NaH.
А ктивні метали взаємодіють з водою за кімнатної температури, метали середньої активності — при нагріванні, малоактивні метали (Cu, Ag, Au, Pt) з водою не взаємодіють
2Na+2H2O 2NaOH + H2
t
Zn +H2O ZnO + H2.
Метали взаємодіють з кислотами з утворенням солей, але в залежності від активності металу, природи та концентрації кислоти продукти відновлення ки-слоти можуть бути різними:
Zn + 2HCl(розв.)ZnCl2 + H2 ;
Cu+4HNO3(конц.)Cu(NO3)2+2NO2+2H2O;
Cu+2H2SO4(конц.)СuSO4+SO2+2H2O.
Деякі метали, що утворюють амфотерні гідроксиди, взаємодіють з лугами:
Zn+2NaOH+2H2ONa2[Zn(OH)4]+H2.
Метали взаємодіють з розчинами солей менш активних металів:
Zn+CuSO4 ZnSO4 + Cu.
Активні метали ( Mg, Al, Na ) взаємодіють з оксидами металів:
t
Fe2O3 + 2Al Al2O3.
Алюміній широко використовують у промисловості для добування бага-тьох металів з їхніх оксидів ( алюмінотермія).
Сплави. У розплавлених металах можуть розчинятися інші метали, складні речовини та неметали. Під час охолодження таких розчинів утворюються сплави. Сплави, як і метали, у твердому стані мають кристалічну будову. Під час кристалізації деяких сплавів утворюються хімічні сполуки. Кристали інших сплавів складаються з атомів вихідних металів, які хімічно не зв’язані один з одним (тверді розчини).
У світі для потреб техніки виробляється 75 металів і близько 1500 різних сплавів. Наприклад, чавун — це залізовуглецевий сплав, у якому масова частка вуглецю понад 2.14%. Сталь — залізовуглецевий сплав з масовою часткою вуглецю меншою за 2.14%. Дюралюміній містить 95% Al, 4%Cu, 0.5%Mg і 0.5%Mn.
Властивості сплавів відрізняються від властивостей компонентів сплаву. Температура плавлення сплаву, як правило, нижча за температуру плавлення найбільш легкоплавкого його компонента, а твердість вища, ніж твердість скла-дових частин сплаву. Особливо сильно зростає твердість сплаву, якщо під час сплавлення утворюються хімічні сполуки металів. Високою твердістю характе-ризуються сплави, що містять тверді розчини. Низькі температури плавлення, висока твердість надають сплавам більшої цінності для сучасної техніки, ніж цінність металів, з яких їх виготовляють.
Поширення у природі й одержання металів. У земних умовах більшість металів є стійкими в окисненому вигляді. У вільному стані в земній корі трапляються лише метали, які в ряду стандартних електродних потенціалів знаходяться праворуч від водню — Cu, Hg, Ag, Au, Pt. Переважно в природі метали існують у вигляді сполук — оксидів, сульфідів, сульфатів, хлоридів, карбонатів, фосфатів і нітратів.
Усі промислові способи одержання металів засновані на окисно–віднов-них реакціях. У процесі добування металів їх переводять з хімічних сполук у нейтральні атоми. Наприклад, пірометалургійні способи полягають у віднов-ленні оксидів за високих температур за допомогою вуглецю, оксиду вугле-цю(II), алюмінію, кремнію або водню
ZnO+CZn+CO.
Гідрометалургійні способи засновані на реакціях переведення сполук металів у розчин і відновлення з них металів за допомогою електролізу або інших металів (цими способами одержують золото, срібло, цинк тощо).
Далі ми більш детально розглянемо властивості сполук магнію та кальцію, тому що вони широко застосовуються у будівництві.
6.2. Магній, кальцій та їхні сполуки
Магній Mg та кальцій Са належать до головної підгрупи ІІ групи еле-ментів періодичної системи. У зовнішньому електронному шарі атомів еле-ментів цієї підгрупи розміщується по два валентних s-електрона, отже, ці елементи є металами.
Поширення в природі. Вміст у земній корі Mg — 2,4, Ca — 2,96 %. У вільному стані ці метали не трапляються. Найважливішими з магнієвих та кальцієвих мінералів є: магнезит MgCO3, доломіт MgCO3·СаCO3, азбест , Mg3Ca(SiO3)4 вапняк, мармур, крейда, склад яких відповідає одній формулі СаCO3, гіпс CaSO42H2O, ангідрит CaSO4.
Оксиди та гідроксиди Mg та Са. Оксиди цих металів у промисловості і в лабораторії добувають термічним розкладанням відповідних карбонатів або гідроксидів.
Наприклад, під час нагрівання магнезиту утворюється оксид магнію (па-лена магнезія)
t
MgCO3 MgO+CO2.
MgO має температуру плавлення 2800С. Сильно прожарений MgO дуже твердий, не розчиняється у воді та кислотах, його використовують для виго-товлення різних вогнетривких виробів і штучних будівельних матеріалів— ксилоліту та фіброліту, а також для одержання магнезіального в’яжучого (магнезіального цементу), який утворюється згідно з рівнянням:
MgO+MgCl2+H2O2MgOHCl.
Магнезіальний цемент—в’яжучий матеріал, використовується для виго-товлення точильних каменів, млинових жорен.
Оксид кальцію одержують розкладанням вапняку CaCO3 за температури 900С:
t
CaCO3 CaO+CO2.
СаО відомий під назвою негашене, або палене, вапно. Після гашення во-дою утворюється гашене вапно:
СаО + Н2О Са(ОН)2.
Воно застосовується у будівництві та у виробництві соди. Суміш гашеного вапна, піску та води називається будівельним розчином.
Солі магнію та кальцію. З солей магнію та кальцію найбільше застосовують карбонати і сульфати кальцію.
Карбонат кальцію СаСО3, наприклад, мармур —цінний будівельний мате-ріал. Великі кількості вапняку та крейди застосовують у цементній та скляній промисловостях. Термічним розкладанням вапняку добувають негашене вапно та вуглекислий газ. Магнезит MgCO3 використовують для добування оксиду магнію.
Термічним розкладанням сульфату кальцію у вигляді мінералу гіпсу CaSO42H2O одержують будівельний гіпс (алебастр)
t
CaSO42H2O CaSO40,5H2O+1,5H2O.
Під час змішування з водою алебастр знову перетворюється на тверду масу — двоводний гіпс CaSO42H2O. Про інші різновиди гіпсу мова піде в розділі 8.
6.3. ТВЕРДІСТЬ ВОДИ ТА МЕТОДИ ЇЇ УСУНЕННЯ
Твердість води зумовлюють катіони Са2+, Mg2+ та катіони деяких важких металів. Оскільки в природних водах переважають іони Са2+ і Mg2+, а інші присутні не завжди і в незначних кількостях, то загальна твердість природних вод може бути охарактеризована сумою концентрацій іонів Са2+ та Mg2+ (ммоль е/л). Один ммоль е відповідає вмісту у воді 20,04 мг/л іонів Са2+ або 12,156 мг/л іонів Mg2+.
Твердість природних вод змінюється в широких межах. За величиною за-гальної твердості природні води поділяються на групи: вода дуже м’яка (менше ніж 1,5 ммоль е/л), вода м’яка (від 1,5 до 3,0 ммоль е/л), вода середньої твердості (від 3,0 до 5,4 ммоль е/л), вода тверда (від 5,4 до 10,7 ммоль е/л), вода дуже тверда (понад 10,7 ммоль е/л).
Найбільш м’якими є води атмосферних осадів, твердість яких становить 0,07-0,1 ммольекв/л. Найбільша твердість спостерігається в водах світового океану, для яких середнє значення твердості дорівнює 130,5 ммольекв/л. Припустима твердість води для господарчо-питного водопостачання становить не більше, ніж 7ммольекв/л.
Загальна твердість поділяється на карбонатну і некарбонатну. Перша з них зумовлена присутністю гідрокарбонатів та карбонатів кальцію і магнію (Ca(HCO3)2, Mg(HCO3)2, CaCO3, MgCO3). Оскільки карбонати кальцію та маг-нію важкорозчинні речовини, то часто під карбонатною твердістю розуміють гідрокарбонатну твердість, зумовлену добре розчинними гідрокарбонатами Ca(HCO3)2, Mg(HCO3)2. Ці солі при нагріванні розкладаються з виділенням оксиду вуглецю (IV) і осаду карбонатів. Таким чином, при кип’ятінні твердість води, спричинена гідрокарбонатами кальцію та магнію, усувається. Тому така твердість називається усувною або тимчасовою.
Сульфати, хлориди, а також кальцієві та магнієві солі інших кислот характеризують некарбонатну або постійну твердість води. Солі, що зумовлю-ють твердість води, не шкідливі для живих організмів, однак наявність їх у великих кількостях небажана, оскільки вода стає непридатною для господарчо-побутових потреб. Тверда вода не дає піни з милом, оскільки розчинні натрієві солі жирних кислот, що входять до складу мила, переходять у нерозчинні кальцієві солі цих кислот.
У твердій воді погано розварюються овочі, крупи, м’ясо, скорочується термін служби тканин, утворюються осади у водопровідних трубах та ін. Тверду воду неможна використовувати у деяких технологічних процесах, наприклад, при фарбуванні. Вода, що містить солі твердості, цілком непридатна для постачання парових котлів через утворення накипу, що призводить до перегріву котла і сприяє його швидкому руйнуванню. Вода з підвищеною тимчасовою твердістю непридатна для охолодження тепло- обмінної апаратури, оскільки при нагріванні гідрокарбонати кальцію та магнію розкладаються до карбонатів, які осідають на стінках теплообмінника.
Наведені приклади вказують на необхідність видалення з води, що вико-ристовується з технічною метою, солей кальцію та магнію. Цей спосіб водопід-готовки називають водопом’якшенням.
Зниження концентрації іонів Са2+ і Mg2+ можна досягти термічними, реа-гентними та іоно-обмінним методами.
При кип’ятінні води усувається переважно тимчасова твердість через ви-ділення осадів CaCO3 та MgCO3:
t
Ca(HCO3)2 CaCO3+CO2+H2O;
t
Mg(HCO3)2MgCO3+CO2+H2O.
Крім того, частково усувається також сульфатна твердість, оскільки роз-чинність CaSO4 зменьшується при підвищенні температури.
Такі ж термічні методи як виморожування та дистиляція дозволяють поз-бутися не тільки солей твердості а і взагалі знесолити воду.
Реагентні методи пом’якшення води засновані на переведенні іонів Са2+ і Mg2+ у важкорозчинні сполуки (карбонати, фосфати та інші): З цією метою вико-ристовують вапно, соду, фосфати, поліфосфати та ін.:
Ca(OH)2 + Ca(HCO3)2 2CaCO3+ 2H2O
Na2CO3 + CaCl2 CaCO3 + 2NaCl
2Na3PO4 + 3Ca(HCO3)2 Ca3(PO4)2 + 6NaHCO3.
Іоно-обмінний метод пом’якшення води полягає в обміні іонів Са2+, Mg2+ та інших металів, що знаходяться у воді, на іони Н+ або Na+, що входять до складу іоногенних груп катіонітів
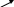 2H2O
+ 2CO2
2H2O
+ 2CO2
2HR + Ca(HCO3)2 <=> CaR2 + 2H2CO3
2NaR +CaSO4 <=> CaR2 + Na2SO4.
Оскільки іонний обмін — оборотний процес, то відновити обмінні влас-тивості катіоніту можна, пропускаючи розчини NaCl або HCl через шар катіо-ніту, який насичений іонами Са2+, Mg2+ або інших металів.
Якщо природну воду пропустити не тільки через Н-катіоніт, а ще й через ОН--аніоніт, то можна позбутися всіх катіонів металів і аніонів, розчинених у воді, тобто повністю знесолити воду.
Розділ 7.
