
- •Л.С.Сухорукова, т.І.Курова, н.І.Мальцева, в.І.Григор’єва,
- •Основи загальної хімії Навчальний посібник
- •Атомно-молекулярне вчення
- •Основні закономірності перебігу хімічних реакцій
- •Розчини. Дисперсні системи
- •Молярна концентрація еквівалента або нормальність (сн) визначається
- •Основи дисоціюють з утворенням катіонів металу і гідроксид-іонів он-:
- •Наприклад, дисоціацію такого індикатора як лакмус, можна описати рівнянням
- •Властивості деяких кислотно-основних індикаторів
- •Ступінь гідролізу визначається співвідношенням:
- •Класифікація дисперсних систем за агрегатним станом дисперсної фази та дисперсійного середовища
- •Зміна механічних властивостей гелю кремнієвої кислоти h2SiO3 при обезводненні
- •Будова речовини
- •Головна підгрупа Побічна група
- •Двох періодів
- •Відносні електронегативності елементів(за шкалою Полінга)
- •2 Відштовхування rзв. Е, кДж/моль
- •Окисно-відновні реакції. Основи електрохімії
- •5.3. Корозія металів. Методи захисту металів від корозії
- •1. Якщо в розчині присутні аніони безкисневих кислот s2-,I-,Br-,Cl- (крім f-) або іони , то відбувається окиснення цих аніонів у послідовності:
- •Неметали
- •Неорганічні в'яжучі речовини
- •Приблизний мінералогічний склад портландцементного клінкеру
- •Характеристики процесів гідратації та продуктів твердіння складових портландцементу
- •Органічні сполуки
- •Найважливіші класи органічних сполук
- •Органічні полімерні матеріали в будівництві
- •Xімія та екологія
Окисно-відновні реакції. Основи електрохімії
5.1. Окиcно-відновні реакціЇ
Окиcно-відновними реакціями називаються реакції, під час яких зміню-ються ступені окиснення елементів, що входять до складу реагуючих речовин. Ступінь окиснення — це умовний заряд атома в молекулі, розрахований, вихо-дячи з припущення, що молекула складається з іонів.
Зміна ступеня окиснення повязана з переходом електронів або зміщен-ням електронних пар.
Для визначення ступеня окиснення існують такі правила:
1. Ступінь окиснення атомів у простих речовинах дорівнює нулю (Сl2, Br2, H2).
2. Ступінь окиснення одноатомного іона дорівнює його заряду. Наприклад, у хлориді натрію ступінь окиснення натрію становить +І, хлору — (І).
3. Ступінь окиснення водню в усіх сполуках становить +1, за винятком гід-ридів металів(NaH, CaH2 та ін.). У гідридах металів його ступінь окиснення (1).
4. Ступінь окиснення кисню в більшості сполук дорівнює –2. У фториді кисню OF2 кисень має ступінь окиснення +2. У пероксидах ступінь окиснення кисню дорівнює (–1) (H2O2, CaО2 ).
5. Елементи головної підгрупи першої групи (Li, Na, K, Rb, Cs, Fr) в усіх сполуках мають ступінь окиснення +1, а елементи головної підгрупи другої групи (Be, Mg, Ca, Sr, Ba, Ra), а також Cd і Zn мають ступінь окиснення +2.
6. Найвищий ступінь окиснення елемента в його сполуках дорівнює номеру групи періодичної системи, в якій знаходиться цей елемент. Наприклад, марга-нець, що міститься у сьомій групі, має найвищий ступінь окиснення +7.
7. Найнижчий ступінь окиснення для металів дорівнює нулю, для неме-талів А 8, де А — номер групи періодичної системи, в якій розташований еле-мент.
8. Сума ступенів окиснення всіх атомів у молекулі дорівнює 0.
Атоми, молекули або іони, що віддають електрони, називаються віднов-никами. Під час реакції вони окиснюються(ступінь окиснення їх збільшується).
Атоми, молекули або іони, що приєднують електрони, називаються окисниками. Під час реакції вони відновлюються(ступінь окиснення зменшу-ється).
Процес віддачі електронів називається окисненням, процес приєднання електронів — відновленням. Кількість електронів, що їх віддає відновник, до-рівнює кількості електронів, які приєднує окисник.
Окисно-відновні властивості елементів залежать від місця елемента в періодичній системі, від ступеня окиснення його в речовині, а також від окисно-відновних властивостей інших речовин, які беруть участь у реакції.
Сполуки,
до складу яких входять атоми в найвищому
ступені окис-нення, можуть бути тільки
окисниками, наприклад:
![]()
![]()
![]() та
інші.
та
інші.
Сполуки,
до складу яких входять атоми в найнижчому
ступені окис-нення, можуть бути тільки
відновниками, наприклад,
![]() та інші.
та інші.
Сполуки,
до складу яких входять атоми в проміжному
ступені окиснення, здатні бути як
окисниками (якщо реагують з сильними
віднов-никами), так і відновниками (при
взаємодії з сильними окисниками),
на-приклад,![]() .
.
При складанні рівнянь окисно-відновних реакцій використовують мето-ди електронного та електроно-іонного балансів.
Метод електронного балансу дає змогу складати рівняння окисно-від-новних реакцій, які відбуваються в водних розчинах, газовій та твердій фазах.
Метод електроно-іонного балансу використовують у рівняннях реак-цій, які відбуваються в розчинах електролітів. В цьому випадку при визначенні коефіцієнтів у рівнянні окисно-відновної реакції виходять не зі ступенів окис-нення, а з реальних зарядів тих іонів, що існують у розчині.
Загальний хід складання рівнянь за обома методами однаковий. Вони різняться лише за п. 4 наведеної нижче послідовності операцій:
1. Записати формули речовин, що вступають у реакцію.
2. Визначити, яка з них у цій реакції виявляє окисні, а яка — відновні властивості. Для цього знайти за формулами речовин ступені окиснення всіх елементів і згідно з їх положенням у періодичній системі визначити, які з них мають вищі ступені окиснення, які — нижчі.
3. Записати формули речовин, на які перетворюються окисники внаслі-док відновлення, та відновники внаслідок окиснення.
4. Скласти електронні (метод електронного балансу) або електроно-іонні схеми (метод електроно-іонного балансу) процесів окиснення та відновлен-ня. Підібрати коефіцієнти в цих схемах так, щоб загальне число електронів, які віддає відновник, дорівнювало загальному числу електронів, що приєднує окисник.
5. Розставити коефіцієнти в молекулярному рівнянні реакції, щоб за-гальна кількість атомів кожного елемента була однакова в лівій та правій ча-стинах рівняння.
Визначимо коефіцієнти за методом електронного балансу в рівнянні ре-акції
![]()

![]() 4
процес окиснення
4
процес окиснення
відновник
![]() 3
процес відновлення
3
процес відновлення
окисник

![]() ;
;
![]() .
.
При використанні електроно-іонного балансу треба мати на увазі, якщо в напівреакції є незбалансований кисень, то надлишок кисню в лівій частині напівреакції в кислому середовищі звязується іонами водню з утворенням молекул води, а в нейтральному та лужному — молекулами води з утворенням гідроксид-іонів OH-. Наприклад:
![]() (кисле
середовище);
(кисле
середовище);
![]() (нейтральне
середовище).
(нейтральне
середовище).
Нестача кисню у лівій частині електроно-іонного рівняння попов-нюється у кислому та нейтральному середовищах киснем з молекул води, при цьому утворюються іони водню, в лужному середовищі — за рахунок гідрок-сид-іонів з утворенням молекул води. Наприклад:
![]() (нейтральне
середовище);
(нейтральне
середовище);
![]() (лужне
середовище).
(лужне
середовище).
Визначимо коефіцієнти за методом електроно-іонного балансу в рівнянні реакції:
![]() ;
;
![]()

![]() 3
процес окиснення;
3
процес окиснення;
ВІДНОВНИК
![]() 1
процес відновлення;
1
процес відновлення;
ОКИСНИК

![]()
![]()
За механізмом перебігу розрізняють три типи окисно-відновних реакцій.
1. Міжмолекулярні — реакції, в яких окисник і відновник входять до складу різних речовин:
![]() .
.
2. Внутрішньомолекулярні — реакції, в яких окисник і відновник (атоми різних елементів) входять до складу однієї й тієї ж речовини:
![]()
3. Реакції диспропорціонування — супроводжуються одночасним збільшенням і зменшенням ступеня окиснення атомів одного й того ж елемента
![]()
Окисно-відновна здатність речовин характеризується окисно-відновним потенціалом, який визначається за формулою Нернста:
![]()
де φ ок/від.— потенціал за даних умов, В;
φ ок/від. — стандартний окисно-відновний потенціал, В;
R — універсальна газова стала;
Т — температура, K;
n — кількість електронів, які беруть участь у реакції;
F — число Фарадея, F=96498Кл/моль;
[від.ф.], [ок.ф.] — концентрації відповідно відновленої та окисненої форм.
Чим позитивніше значення окисно-відновного потенціалу, тим сильніше виявлені властивості даного окисника і навпаки чим менше значення окисно-відновного потенціалу, тим сильніші властивості відновника.
Обовязковою умовою перебігу будь-якої окисно-відновної реакції є позитивне значення різниці потенціалів окисника і відновника
![]() ,
,
де φок, φвід. — стандартний потенціал відповідно окисника і відновника .
Чим більша різниця φ, тим енергійніше відбувається реакція.
5.2. Електродні потенціали. ГАЛЬВАНІЧНІ елементи
Електрохімічними процесами називаються процеси, при яких відбува-ються перетворення хімічної енергії в електричну й навпаки. Їх поділяють на дві основні групи:
1) процеси перетворення хімічної енергії в електричну (процеси в гальва-нічних і паливних елементах);
2) процеси перетворення електричної енергії в хімічну (процеси при електролізі).
Електрохімічна система складається з двох електродів та іонного провід-ника між ними. Електроди замикаються металевим провідником, який назива-ється зовнішньою частиною кола електрохімічної системи. Іонний провідник (провідник 2 роду) — це розчин або розплав електроліту. Електродами назива-ються провідники, що мають електронну провідність (провідники 1 роду) і зна-ходяться в контакті з іонним провідником.
Процеси, які відбуваються на межі поділу метал — розчин солі металу, характеризуються переносом заряду і речовини через межу поділу фаз “тверда речовина — розчин”.
У металі існує рівновага:
Me(k) <=> Men+(k) + ne.
При зануренні металевої пластини у водний розчин його солі позитивно заряджені іони поверхневого шару металу взаємодіють з полярними моле-кулами води, гідратуються, і переходять до розчину згідно з рівнянням:
Men+(k) + mH2O Men+(k) ∙ mH2O.
Внаслідок такого переходу пластина завдяки появі в ній надлишкових електронів заряджується негативно. Гідратовані катіони металу концентрую-ться у приелектродному просторі, і на межі поділу двох фаз метал — розчин утворюється подвійний електричний шар (рис. 23).

Рис. 23. Схема виникнення подвійного електричного шару
Між металом та розчином виникає різниця потенціалів, яка називається електродним потенціалом. При деякому значенні електродного потенціалу між металом і розчином встановлюється рівновага:
Me(к)+ mH2O <=> Men+ · mH2O(p-н) + ne.
Стан цієї рівноваги залежить від активності металу та концентрації іонів металу в розчині. Якщо концентрація катіонів металу в розчині мала або метал доволі активний (невелика величина енергії іонізації його атомів), то гетеро-генна рівновага зміщується праворуч і металева пластина заряджається не-гативно. У випадку, коли концентрація катіонів металу в розчині велика або метал малоактивний (значна енергія іонізації його атомів), рівновага зміщу-ється ліворуч, і метал заряджається позитивно.
Потенціал металевого електрода, зануреного в розчин солі того ж самого металу з активністю а, обчислюють за рівнянням Нернста, яке в цьому разі має вигляд:
![]()
Підставивши в це рівняння значення сталих величин, для досить розбавлених розчинів за температури 298К матимемо:
![]() .
.
Електродний потенціал металу, зануреного в розчин власних іонів з їхньою активністю 1 моль/л, виміряний за стандартних умов відносно стандартного водневого електрода називають стандартним потенціалом металічного електрода.
Абсолютні значення електродних потенціалів виміряти неможливо. Тому використовують відносні значення електродних потенціалів, які вимі-рюють щодо стандартного електрода порівняння. В ролі електрода порівняння, стандартний електродний потенціал якого умовно вважають нульовим, вико-ристовують стандартний водневий електрод. Стандартний водневий електрод— це платинова пластина, що покрита дрібнозернистою платиною, насичена воднем при t = 25 0 С і тиску водню 101,3 кПа і занурена в розчин кислоти з активністю іонів водню H+ 1 моль/л.
На водневому електроді встановлюється рівновага
2H+ + 2e <=> H2.
Теорія електродних потенціалів пояснює процеси, які відбуваються в хімічних джерелах електричного струму — гальванічних елементах. Прилад, що служить для перетворення хімічної енергії окисно-відновної реакції на елек-тричну, називається гальванічним елементом або хімічним джерелом струму. У гальванічному елементі електрони переходять від відновника до окисника не безпосередньо, а по провіднику електричного струму — по зовнішньому колу.
Гальванічний елемент складається з двох металевих електродів, занурених у розчини електролітів. Наприклад, гальванічний елемент Даніеля-Якобі складається з цинкового електрода, зануреного в розчин сульфату цинку ZnSO4, та мідного електрода — у розчин сульфату міді CuSO4 (рис. 24).
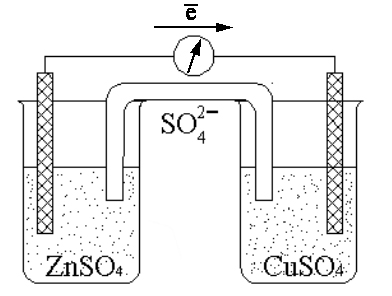
Рис.24. Схема гальванічного елемента Даніеля-Якобі
Розчини поділені пористою перетинкою для запобігання змішування. На поверхні кожного з електродів утворюється подвійний електричний шар і встановлюється рівновага
Zn0 Zn2+ + 2e;
Cu0 Cu2+ + 2e.
Внаслідок цього виникає електродний потенціал цинку й міді. Потенціал цинкового електрода має більш негативне значення, ніж потенціал мідного електрода, тому при замиканні зовнішньої частини кола, тобто при з’єднанні цинку з міддю металевим провідником, електрони будуть переходити від цинку до міді. Внаслідок цього рівновага на цинковому електроді зміститься праворуч і в розчин перейде додаткова кількість іонів цинку. У той же час рівновага на мідному електроді зміститься ліворуч і відбудеться розрядження іонів міді. Розглянуті процеси будуть продовжуватися доти, доки не вирівняються потен-ціали електродів або не розчинеться весь цинк, або не висадиться на мідному електроді вся мідь.
Отже, при роботі елемента Даніеля-Якобі на цинковому електроді відбувається окиснення атомів цинку в іони
Zn0 –2e Zn2+.
При цьому електрони надходять до зовнішньої частини кола. На мідному електроді відбувається процес відновлення іонів міді в атоми, які осаджуються на електроді:
Cu2++2e®Cu0.
Одночасно надлишок іонів SO42- переходить крізь пористу перетинку в посудину з розчином сульфата цинку ZnSO4.
Склавши електродні рівняння, одержуємо
Zn0+Cu2+Zn2++Cu0.
Внаслідок самочинного перебігу цієї електрохімічної реакції при зами-канні зовнішньої частини кола в системі виникає електричний струм.
Електрод, на якому відбувається окиснення, називають анодом, а елект-род, на якому відбувається відновлення — катодом. Якщо гальванічний еле-мент складається з двох металевих електродів, які занурені в розчини їхніх со-лей, то метал з більш позитивним значенням потенціалу є катодом, а з більш негативним — анодом.
При схематичному запису елемента межу поділу між провідником пер-шого роду і провідником другого роду позначають однією вертикальною рис-кою, а межу поділу між провідниками другого роду — двома рисками, на-приклад, схема елемента Даніеля-Якобі має вигляд:
Zn | Zn2+ ||Cu2+ |Cu.
Основною характеристикою елемента є електрорушійна сила ЕРС (Е). Вона завжди є величиною позитивною і визначається за формулою
EРС = k - a,
де k і a — потенціали відповідно катода і анода.
Електрорушійна сила пов′язана зі зміною енергії Гіббса співвідношенням
G = -n FE,
де n — кількість електронів, які беруть участь в одиничному акті.
З метою практичного використання стандартних електродних потенціа-лів металів їх розміщують в ряд у порядку збільшення значень стандартних електродних потенціалів, що відповідає зменшенню хімічної активності мета-лів. Цей ряд називають рядом стандартних електродних потенціалів або електрохімічним рядом напруг.
Li
|
K |
Ca |
Na |
Mg |
Al |
Zn |
Fe |
Sn |
Pb |
H2 |
Cu |
Ag |
Au |
-3,04 |
-2,92 |
-2,87 |
-2,71 |
-2,37 |
-1,66 |
-0,76 |
-0,44 |
-0,14 |
-0,13 |
0,00 |
+0,34 |
+0,80 |
+1,50 |
З ряду стандартних електродних потенціалів металів випливає кілька важливих практичних висновків.
Чим менший стандартний електродний потенціал металу, тим він є хіміч-но більш активним і тим легше він окиснюється і складніше відновлю-ється зі своїх іонів;
Метали, що мають негативне значення стандартних електродних потен-ціалів, витісняють водень з розчинів розбавлених кислот, наприклад:
Zn+H2SO4ZnSO4+H2.
Кожний метал витісняє з солей інші метали, що розміщуються в ряду стандартних електродних потенціалів правіше за нього, наприклад:
Zn+CuSO4 Zn SO4+Cu.
Метали, що стоять у ряду стандартних електродних потенціалів до магнію, настільки активні, що витісняють водень з води:
2Na+2H2O2NaOH+H2.
Ч им більша різниця між значеннями стандартних електродних потен-ціалів металів, тим інтенсивніше за інших однакових умов відбувається процес витіснення.
