
- •Л.С.Сухорукова, т.І.Курова, н.І.Мальцева, в.І.Григор’єва,
- •Основи загальної хімії Навчальний посібник
- •Атомно-молекулярне вчення
- •Основні закономірності перебігу хімічних реакцій
- •Розчини. Дисперсні системи
- •Молярна концентрація еквівалента або нормальність (сн) визначається
- •Основи дисоціюють з утворенням катіонів металу і гідроксид-іонів он-:
- •Наприклад, дисоціацію такого індикатора як лакмус, можна описати рівнянням
- •Властивості деяких кислотно-основних індикаторів
- •Ступінь гідролізу визначається співвідношенням:
- •Класифікація дисперсних систем за агрегатним станом дисперсної фази та дисперсійного середовища
- •Зміна механічних властивостей гелю кремнієвої кислоти h2SiO3 при обезводненні
- •Будова речовини
- •Головна підгрупа Побічна група
- •Двох періодів
- •Відносні електронегативності елементів(за шкалою Полінга)
- •2 Відштовхування rзв. Е, кДж/моль
- •Окисно-відновні реакції. Основи електрохімії
- •5.3. Корозія металів. Методи захисту металів від корозії
- •1. Якщо в розчині присутні аніони безкисневих кислот s2-,I-,Br-,Cl- (крім f-) або іони , то відбувається окиснення цих аніонів у послідовності:
- •Неметали
- •Неорганічні в'яжучі речовини
- •Приблизний мінералогічний склад портландцементного клінкеру
- •Характеристики процесів гідратації та продуктів твердіння складових портландцементу
- •Органічні сполуки
- •Найважливіші класи органічних сполук
- •Органічні полімерні матеріали в будівництві
- •Xімія та екологія
Неметали
7.1. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
До неметалів належать елементи, атоми яких мають на зовнішньому енергетичному рівні чотири й більше електронів (за винятком водню і бору; у атомів водню — один електрон, у бору — 3). Неметалів значно менше ніж металів. Із відомих 110 елементів 22 є неметалами: водень, інертні гази (He, Ne, Ar, Kr, Xe, Rn), галогени (F, Cl, Br, I, At), кисень, сірка, селен, телур, азот, фосфор, миш’як, вуглець, кремній, бор. У періодичній системі вони містяться в її правій верхній частині лише в головних підгрупах. Межа проходить по умовній лінії, яка з’єднала б такі елементи, як бор і астат.
Елементи-неметали належать до р-елементів, за виключенням водню і гелію, які є s-елементами. Усі неметалічні р-елементи мають загальні власти-вості, бо структура зовнішнього електорнного шару їхніх атомів подібна: ns2np1-5. У елементів благородних газів, на відміну від типових неметалів, р-підрівень є завершеним (має шість електронів) ns2 np6. Це зумовлює вкрай низьку їхню реакційну здатність, тому благородні гази не відносять до типових неметалів.
Елементи-неметали виявляють значну спорідненість до електронa і знач-но більш високу енергію іонізації порівняно з елементами-металами. Вступа-ючи в хімічну взаємодію, атоми неметалів, як правило, приєднують електрони, виявляючи властивості окисників. Здатність приєднувати електрони підви-щується зі збільшенням порядкового номера неметалу в періоді, та змен-шується з його зростанням у групі. Отже, в періоді зліва направо відбувається посилення неметалічних властивостей елементів, а в групах зверху вниз—послаблення. За здатністю приєднувати електрони елементи можна розта-шувати в такій послідовності:
FOClNSCPHSi,
Атоми неметалів, крім фтору й кисню, здатні також віддавати електрони, тому в сполуках можуть мати як негативні так і позитивні ступені окиснення. Наприклад:
![]() (S
- відновник);
(S
- відновник);
![]() (S - окисник).
(S - окисник).
Уявлення про метали і неметали досить умовне. Деякі хімічні елементи (германій, сурма) виявляють властивості, за якими їх можна віднести як до ме-талів, так і до неметалів.Телур і йод — типові неметали, але мають деякі вла-стивості притаманні металам.
При переході від одного елемента до іншого в підгрупі або періоді пері-одичної системи простежується плавна зміна металічних і неметалічних власти-востей.
Неметали як прості речовини. Прості речовини неметали існують у вигляді двохатомних або багатоатомних молекул. Атоми елементів неметалів 2-го періоду, а також водень, утворюють між собою хімічні зв’язки лише за рахунок неспарених s-електронів (водень) і р-електронів і тому вони двоатомні, наприклад водень (H2), кисень (O2), азот (N2) та молекули галогенів (F2), (Cl2) тощо. Виняток становлять бор і вуглець як тверді речовини. Елементи неметали 3-го періоду утворюють додаткові зв’язки за рахунок вакантних d - орбіталей, тому їхні прості речовини багатоатомні за звичайних умов, наприклад, білий фосфор Р4 , сірка S8.
Більшість неметалів у твердому стані мають молекулярну структуру (молекулярні кристалічні решітки). За звичайних умов — це гази (водень, азот, фтор, хлор, кисень), рідини (бром), або тверді речовини (йод, сірка, фосфор) з низькими температурами плавлення. Бор, вуглець (алмаз), кремній, миш’як, селен, телур — мають атомну структуру (атомні кристалічні решітки). Тому вони є дуже твердими речовинами з високими температурами плавлення. Неметали з молекулярною структурою являються діелектриками, а з атомною структурою — напівпровідниками і лише графіт є провідником. Усі неметали є крихкими і погано проводять тепло.
Хімічні властивості неметалів. Типові неметали взаємодіють з металами, утворюючи сполуки з іонним зв’язком (NaCl, MgO, CaS), а також взаємодіють між собою, утворюючи сполуки з ковалентним зв’язком. Наприклад, у воді H2O, аміаку NH3, зв’язок ковалентний полярний, в метані CH4 — ковалентний малополярний. З киснем неметали утворюють оксиди, переважна більшість яких належить до кислотних, гідроксиди цих оксидів є кислотами. З воднем неметали утворюють леткі водневі сполуки: HCl, HBr, H2S, NH3, CH4.
Для неметалів характерні реакції сполучення й заміщення. Ці реакції є окисно-відновними.
Поширеність у природі і добування неметалів. Найбільш активні неметали — галогени зустрічаються у природі виключно у вигляді сполук, головним чином з лужними металами (карналіт KClMgCl26H2O, флюоріт CaF2, кам’яна сіль NaCl); кисень, сірка, кремній також активні мінералоутворювачі (вапняки CaCO3, кірит FeS2, силікати і алюмосилікати Al2O32SiO22H2O, сульфати (гіпс CaSO42H2O). Деякі неметали зустрічаються в природі також і у вільному стані — вуглець, кисень, азот, сірка та інші.
Більшість простих речовин неметалів добувають з природних сполук внаслідок окисно-відновних процесів.
Наприклад, хлор добувають електролізом хлориду натрію NaCl або окисненням HСl діоксидом марганцю MnO2.
4HCl + MnO2 → MnCl2 + 2H2O + Cl2.
Далі ми більш детально розглянемо властивості сполук вуглецю та кремнію, тому що вони широко застосовуються в будівництві.
7.2. ВУГЛЕЦЬ ТА ЙОГО НЕОРГАНІЧНІ СПОЛУКИ
Вуглець — один з найважливіших елементів у природі. Його сполуки становлять основу живої природи — флори і фауни.
У неживій природі найпоширенішими сполуками вуглецю є карбонати, які утворюють такі мінерали як вапняк, крейда, мармур (усі вони складаються з СаСО3), магнезит МgCO3, доломіт CaCO3MgCO3, залізний шпат FeCO3, малахіт CuCO3Cu(OH)2. Крім того, вуглець входить до складу вугілля, нафти, природ-ного газу, торфу, сланців та атмосфери у вигляді СО2.
У природі вуглець трапляється також у вигляді трьох алотропних моди-фікацій — алмазу, графіту, карбіну. Це тверді речовини з атомними кристаліч-ними решітками, які відрізняються будовою кристалів і фізичними власти-востями. Різновидами графіту є кокс, деревне вугілля, сажа.
Хімічні властивості. Вуглець міститься в головній підгрупі четвертої групи періодичної системи. Електронна конфігурація зовнішнього рівня його атомів 2s22p2. У незбудженому стані атом вуглецю має на р-підрівні зовнішнього рівня два неспарених електрони та вільну р-орбіталь, на яку під час збудження атома може переходити розпарований електрон s-підрівня, внаслідок чого утворю-ються чотири неспарених електрони:
↓ ↓ ↓ ↓
↓↑ ↓ ↓
s p s
2 2 2 2 2
незбуджений збуджений
стан стан
У відповідності до такої електронної будови атома вуглець у своїх спо-луках може бути дво- та чотиривалентним і виявляти ступені окиснення -4, +2,+4.
Вуглець — типовий неметал, утворює сполуки переважно з ковалентним зв’язком. Унікальність вуглецю полягає в здатності його атомів з’єднуватися між собою в довгі ланцюги, в тому числі циклічні, утворюючи велику кількість органічних сполук.
За звичайних умов вуглець хімічно малоактивний, однак при нагріванні взаємодіє з багатьма речовинами — киснем, сіркою, азотом, металами, оксидами металів, виявляючи властивості як відновника, так і окисника, причому відновні властивості виявляються сильніше, ніж окисні.
Найбільш реакційноздатною формою є аморфний вуглець (дуже дрібні кристалики графіту з великою поверхнею), найінертнішім є алмаз.
Відновні властивості вуглецю реалізуються в реакціях з більш електро-негативними неметалами: фтором, киснем, сіркою, азотом, а також з оксидами металів і водою. Наприклад:
t
t
С + 2S → СS2;
сірковуглець
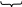 С
+ Н2О
СО + Н2.
С
+ Н2О
СО + Н2.
водяний газ
Вуглець горить у повітрі. Продукт реакції залежить від кількості кисню, при його надлишку утворюється СО2, при нестачі ―СО:
С + О2 СО2; 2C + O2 2CO
Вуглець стійкий до дії лугів та кислот. Лише концентрована азотна та сірчана кислоти за температури 100°С окиснюють його до СО2
C + 4HNO3 (конц) CO2 + 4NO2 + 2H2O
C + 2H2SO4 (конц) CO2 + 2SO2 + 2H2O.
Окисні властивості вуглецю виявляються у взаємодії його з металами, а також з менш електронегативними неметалами (воднем, бором, кремнієм):
3C +4Al Al4C3
карбід алюмінію
С + Si SiC
карбід кремнію (карборунд)
Ni,Pt
С + 2Н2 → CH4.
метан
Кисневі сполуки вуглецю. Вуглець утворює два оксиди: оксид вуглецю (II) CO та оксид вуглецю (IV) CO2.
Оксид вуглецю (II) (монооксид, чадний газ). Це безбарвний отруйний газ, без запаху, дуже мало розчинний у воді. Він утворюється при згорянні різ-ного палива (дров, вугілля, природного газу) при нестачі кисню. Цей оксид є несолетворним і за звичайних умов не взаємодіє з водою, кислотами, лугами. При підвищених температурах він схильний до реакцій приєднання та окис-нення — відновлення.
Оксид вуглецю (II) горить у повітрі та кисні блакитним полум’ям з виділенням великої кількості теплоти:
2CO + O2 2CO2.
На цьому засноване його використання як палива. Так, він входить до складу деяких газових горючих сумішей: генераторного газу (СО в суміші з азотом) і водяного газу (СО в суміші з воднем).
Оксид вуглецю (II) є сильним відновником, тому в промисловості його використовують для відновлення металів з їхніх оксидів:
Fe2O3 + 3CO 2Fe + 3CO2.
Оксид вуглецю (IV) (діоксид вуглецю, вуглекислий газ) СО2. Це безбар-вний газ, без запаху. При зниженій температурі або підвищеному тиску СО2 переходить в тверду снігоподібну масу (сухий лід), який сублімується, тобто знов перетворюється в газ, минаючи рідкий стан.
У промисловості СО2 добувають випалюванням вапняку
t
CaCO3 CaO + CO2.
У лабораторії СО2 добувають дією кислот на карбонати
CaCO3 + 2HCl CaCl2 + CO2 + H2O.
Оксид вуглецю (IV) — кислотний оксид і виявляє всі властивості кислот-них оксидів — взаємодіє з основними оксидами і лугами, утворюючи солі вугільної кислоти — карбонати і гідрокарбонати:
CO2 + CaO CaCO3
CO2 + Сa(OH)2 CaCO3 + H2O
2CO2 + Ca(OH)2 Ca(HCO3)2.
Оксид вуглецю (IV) розчиняється у воді з утворенням вугільної кислоти:
CO2 + H2O <=> H2CO3.
Рівновага дуже зміщена в бік вихідних речовин, тобто дуже мало розчиненого СО2 перетворюється на кислоту.
Вугільна кислота та її солі. У вільному стані вугільна кислота невідома, оскільки вона нестійка і легко розкладається. Це дуже cлабка двохосновна кислота, яка у водному розчині дисоціює ступінчасто:
H2CO3 <=> H+ + HCO3-; К1 = 410-7
HCO3- <=> H+ + CO32-; К2 =510-11
При розчиненні СО2 у воді в розчині встановлюється динамічна рівновага – карбонатна рівновага:
К1 К2
CO2 + H2O <=> H2CO3 <=> H+ + HCO3- <=> 2H+ + CO32-.
Оскільки дисоціація вугільної кислоти за другим ступенем дуже незначна, то основна карбонатна рівновага являє собою систему з вільної кислоти і гідрокарбонат-іонів:
CO2 + H2O <=> H2CO3 <=>H+ + HCO3-.
Для вугільної кислоти характерні всі властивості кислот. Як двоосновна кислота вона утворює два типи солей: середні солі — карбонати і кислі —гідрокарбонати. Усі солі вугільної кислоти розкладаються при нагріванні:
t
Ca(HCO3)2 → CaCO3 + H2O + CO2;
t
CaCO3 → CaO + CO2.
Першу реакцію використовують для пом’якшення води, другу для добу-вання СаО (негашеного вапна) та вуглекислого газу в техніці. Під дією сильних кислот на солі вугільної кислоти виділяється вуглекислий газ
CaCO3 + 2HCl CaCl2 + CO2 + H2O
Ca(HCO3)2 + 2HCl CaCl2 + 2CO2 + 2H2O.
Взаємодію солей вугільної кислоти з сильними кислотами використо-вують для того, щоб відрізнити їх від інших солей. На зразок, який аналізують, діють кислотою: CO2, який виділяється, пропускають через вапняну воду (насичений розчин Са(ОН)2) і внаслідок осідання малорозчинного карбонату кальцію розчин мутніє. Всі гідрокарбонати, карбонати лужних металів і амонію добре розчиняються у воді. Карбонати інших металів у воді не розчиняються. Розчини карбонатів мають лужну реакцію внаслідок гідролізу:
CO32- + H2O <=> HCO3- + OH- (pH>7).
У природі гідрокарбонати утворюються, коли породи, що містять СаСО3, зазнають дії води та розчиненого в ній СО2. При достатньому вмісті СО2 в природних водах вони можуть розчиняти вапняк, перетворюючи нерозчинний карбонат кальцію на розчинний гідрокарбонат
CaCO3 + H2O + CO2 <=> Ca(HCO3)2
CaCO3 + H2O + CO2 <=> Ca2+ + 2HCO3-.
Цей процес є причиною появи солей твердості в природних водах. При цому встановлюється рівновага між нерозчинними карбонатами і розчинними гідро-карбонатами (вуглекислотна рівновага). Константа цієї рівноваги в присутності твердої фази СаСО3 при практично постійній концентрації води має вигляд:
![]()
і називається константою вуглекислотної рівноваги.
Та частина розчиненого в воді діоксиду вуглецю, яка входить до виразу константи вуглекислотної рівноваги між карбонатами і гідрокарбонатами називається рівноважним або інактивним діоксидом вуглецю. Підвищення концентрації СО2 в розчині викликає перехід відповідної кількості карбонату кальцію в гідрокарбонат, що супроводжується зниженням концентрації СО2 до рівноважної. Тому кількість СО2, надлишкова по відношенню до рівноважної, носить назву агресивного діоксиду вуглецю. Якщо така підвищена концентра-ція СО2 у воді підтримується за рахунок надходження його ззовні, то вода стає агресивною по відношенню до карбонату кальцію, тобто розчиняє його.
У протилежному випадку, тобто при зниженні концентрації СО2, гідро-карбонат кальцію розкладається з виділенням в осад СаСО3. В природних умо-вах такий процес відбувається, коли глибинні води, насичені діоксидом вугле-цю під тиском, виходять на поверхню.
Використання. Матеріали, що містять вуглець, широко застосовуються в народному господарстві. Значна кількость коксу використовується при добу-ванні кремнію, для виробництва активованого вугілля. Вугілля різних видів за-стосовується для добування металів і карбідів.
Алмаз у промисловості застосовується для різання скла, шліфування металів та інших твердих матеріалів. Його великі прозорі відшліфовані кристали (діаманти) використовують для виготовлення ювелірних прикрас. Графіт добре проводить електричний струм і тепло, його використовують для виготовлення електродів, олівців і як мастило.
Активоване вугілля використовують для поглинання пари летких речо-вин з повітря та газових сумішей (наприклад у протигазах), для очищення води, продуктів харчування, а також як каталізатор у деяких хімічних виробництвах.
Важливе практичне значення мають різні карбонати. Карбонат натрію Na2CO3 застосовується у виробництві скла, мила і мийних засобів. Карбонат кальцію СаСО3 є основним компонентом природних матеріалів: вапняку, крейди, мармуру, які широко застосовуються у будівництві. Крім того, він є сировиною для добування цементу, вапна.
7.3. КРЕМНІЙ ТА ЙОГО СПОЛУКИ
Поширення у природі. За поширенням у земній корі кремній посідає друге місце після кисню. Масова частка кремнію в земній корі становить 27,6%. У природі кремній трапляється лише у вигляді сполук. Вуглець — головний елемент живої природи, а кремній — неживої. Більшість гірських порід утво-рені силікатами — сполуками кремнію. Сполуки кремнію входять до складу рослин, містяться також у живих організмах.
Кремній — кристалічна речовина сіро-стального кольору з металічним блиском. Структура кремнію аналогічна структурі алмазу. В його кристалі кожний атом кремнію зв’язаний з іншими чотирма ковалентними зв’язками, які напрямлені до вершин тетраедра. Ці зв’язки слабші, ніж у алмазі.
Кремній одержують внаслідок відновлення оксиду кремнію (IV) коксом або магнієм, алюмінієм за високих температур:
t
SiO2 + 2C → Si + 2CO;
t
SiO2 + 2Mg → Si + 2MgO.
Кремній високої чистоти одержують термічним розкладанням йодиду кремнію (IV) на танталовій стрічці за температури 1000ºС:
t
SiI4 → Si + 2I2.
Хімічні властивості. Кремній належить до головної підгрупи четвертої групи періодичної системи. Електронна конфігурація зовнішнього рівня 3s23p2. В незбудженому стані кремній, як і вуглець, має на р-підрівні зовнішнього рівня два неспарених електрони та вільну р-орбіталь, на яку під час збудження атома може переходити розпарований електрон s-підрівня, внаслідок чого утво-рюється чотири неспарених електрони. У відповідності до такої електронної будови атома кремній у своїх сполуках може виявляти ступені окиснення –4, +2, +4. Найбільш типовий ступінь окиснення кремнію ― (+4).
Кремній має слабші неметалічні властивості, ніж вуглець, тому що радіус його атома більший і зовнішні електрони знаходяться далі від ядра.
Відновні властивості. Під час сильного нагрівання кремній горить на повітрі
Si + O2 → SiO2.
Зі фтором кремній взаємодіє за звичайних умов, з іншими галогенами – під час нагрівання:
Si + 2F2 → SiF4;
t
Si + 2Cl2 → SiCl4.
Фторид кремнію SiF4 у водних розчинах гідролізує
SiF4 + 3H2O → H2SiO3 + 4HF.
Фтороводень HF, що утворюється при цьому, взаємодіє з SiF4, утворюючи гексафторокремнієвую кислоту H2SiF6
SiF4 + 2HF → H2SiF6.
Розчинні солі цієї кислоти (фторосилікати магнію, цинку, алюмінію) застосо-вують у будівництві для обробки поверхні будівельного каменю, щоб зробити її водонепроникною.
За високої температури кремній взаємодіє з вуглецем з утворенням карбіду кремнію (карборунду)
t
Si + C → SiC.
Карборунд має алмазоподібні кристалічні гратки, в яких кожний атом кремнію оточений чотирма атомами вуглецю і навпаки, а ковалентні зв’язки дуже міцні. Тому за твердістю карборунд наближається до алмазу. З карборунду виготов-ляють шліфувальні та точильні камені.
Кремній реагує з розплавами або з розчинами лугів
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑.
Кремній не взаємодіє з кислотами (окрім суміші плавикової HF та азотної HNO3)
3Si + 4HNO3 + 12HF → 3SiF4 +4NO + 8H2O.
Окисні властивості. Під час нагрівання кремній взаємодіє з багатьма металами, утворюючи силіциди, в яких кремній виявляє ступінь окиснення (–4).
З воднем кремній безпосередньо не реагує, але внаслідок дії кислот на силіциди металів утворюються кремневодні, або силани:
Mg2Si + 4HCl → 2MgCl2 + SiH4.
силан
Силан — безбарвний газ з неприємним запахом, дуже отруйний. Він є сильним відновником, який самозаймається на повітрі
SiH4 +2O2 → SiO2 + 2H2O.
Використання. Кремній використовують для одержання різних сплавів. Сталь з масовою часткою кремнію 4% (електротехнічна сталь) використовується для виготовлення трансформаторів, двигунів, генераторів завдяки тому, що вона легко намагнічується та розмагнічується. Зі сталі з масовою часткою кремнію 16% і більше (кислотостійка) виготовляють апарати для хімічної промисло-вості.
Кристалічний кремній як напівпровідник використовується в радіо та електротехніці. З кремнію виготовляють сонячні батареї.
Кисневі сполуки кремнію. Оксид кремнію (IV) SiO2 (діоксид кремнію, кремнезем) — тверда тугоплавка речовина, широко розповсюджена в природі в двох видозмінах: 1) кристалічний кремнезем — мінерал кварц і його різновиди (гірський кришталь, агат, пісок, кремінь); 2) аморфний кремнезем — мінерал опал, діатоміт, трепел, або інфузорна земля.
Різка відмінність фізичних властивостей оксиду кремнію (IV) SiO2 від оксиду вуглецю (IV) СО2 поясняються різною будовою кристалічних решіток. СО2 кристалізується в молекулярних решітках, а SiO2 – в атомних. Структуру SiO2 в площинному зображенні можна подати у вигляді:

О O
 O
Si O Si O
O
Si O Si O
O O
O Si О Si О
О O
Кожний атом кремнію знаходиться в центрі тетраедра, а в вершинах тетраедра розташовані атоми кисню. Окремі тетраедри з’єднуються один з одним вершинами за допомогою спільних атомів кисню. Всю масу кремнезему можна розглядати як кристал, формула якого (SiO2)n. Така будова SiO2 зумов-лює його високу твердість та тугоплавкість. Тетраедри SiO4 можуть по-різному розміщуватися в просторі, утворюючи різноманітні кристалічні структури SiO2. Ці кристалічні модифікації SiO2 можуть в значній або в незначній мірі відрізнятися між собою за фізичними та хімічними властивостями і за певних температур можуть переходити з однієї в іншу.
Оксид кремнію (IV) є кислотним. Під час його сплавлення з лугами, карбонатами лужних металів або основними оксидами утворюються солі кремнієвої кислоти — силікати
SiO2 + 2NaOH → Na2SiO3 + H2O;
SiO2 + Na2CO3 → Na2SiO3 + CO2;
SiO2 + CaO → CaSiO3.
Кислоти, крім фтороводневої, не діють на оксид кремнію (IV). Під час взаємодії фтороводневої кислоти з SiO2 утворюється газоподібний фторид кремнію SiF4
SiO2 + 4HF → SiF4 + 2H2O.
Цю реакцію використовують для нанесення надписів на склі.
SiO2 у воді за звичайних умов практично не розчиняється і хімічно з нею не взаємодіє. Тому кремнієві кислоти отримують непрямим шляхом. Наприклад, метакремнієву кислоту отримують дією іншої кислоти на її солі
Na2SiO3 + 2HCl → NaCl + H2SiO3↓.
Загальна формула кремнієвих кислот — ySiO2·zH2O.
У вільному стані існують такі кислоти:
ортокремнієва кислота H4SiO4 або SiO2·2H2O;
метакремнієва кислота H2SiO3 або SiO2·H2O;
двометакремнієва кислота H2Si2O5 або 2SiO2·H2O.
Кремнієві кислоти — слабкі малостійкі сполуки. Наприклад, для метакрем-нієвої кислоти константи дисоціації мають значення
H2SiO3 <=> H+ + HSiO3-; К1=2·10-10
HSiO3- <=> H+ + SiO32-; К2=1·10-12
Метакремнієва кислота розчиняється в лугах, утворюючи солі
H2SiO3 + 2NaOH → Na2SiO3 + 2H2O.
П
t
H2SiO3 → SiO2 + H2O.
Кремнієві кислоти нестійкі і в водних розчинах вони поліконденсуються з утворенням полікремнієвих кислот. Схематично цей складний процес зобра-жується схемою:
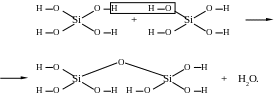
Полікремнієві кислоти у воді практично не розчиняються і легко утворюють колоїдні розчини — золі. Будову міцели золя полікремнієвої кислоти зоб-ражують формулою
{[m(ySiO2·zH2O)nHSiO3-·(n-x)H+]}Х- x H+.
Стійкість золей полікремнієвих кислот дуже залежить від рН середовища. Вони найбільш стійкі в лужному середовищі. В кислому середовищі золі порівняно швидко можуть переходити в гель змінного складу загальної фор-мули SiO2·xH2O. Висушені гелі називаються силікагелями. Вони характери-зуються дуже розвиненою внутрішньою поверхнею і широко викорис-товуються для поглинання пари органічних розчинників, для освітлення рідин.
Солі кремнієвих кислот. Солі кремнієвих кислот — силікати. У воді розчиняються лише силікати лужних металів. Враховуючи складність структури силікатів, їх зображують у вигляді сполук оксидів елементів
Na2SiO3 — Na2O·SiO2;
CaSiO3 — CaO·SiO2-.
Розчини силікатів натрію та калію називають рідким склом. Його одержують сплавленням кварцового піску з содою, або обробкою аморфного кремнезему концентрованим розчином лугу
SiO2 + Na2CO3 → Na2SiO3 + CO2;
SiO2 + 2NaOH → Na2SiO3 + H2O.
Рідке скло застосовують як зв'язуючий матеріал при виготовленні кислототривких бетонів, замазок, конторського клею. Його також використо-вують для просочення тканини, дерева, паперу для надання їм вогнестійкості та водонепроникності.
Природні силікати та алюмосилікати. Більшість природних силікатів є солями полікремнієвих кислот і мають складну будову. Вони схильні взаємодіяти з водою, утворюючи гідросилікати. Вода може входити до кристалічних решіток у вигляді молекул або іонів ОН-. За звичайних умов гідратовані силікати більш стійкі, ніж безводні. Найбільш поширені в природі силікати мають в своєму складі алюміній, причому, алюміній може знаходитись в силікатах у двох формах: у вигляді катіону (силікати алюмінію) або заміщувати собою атом кремнію в тетраедрі SiO4, тобто входити до складу аніону — це алюмосилікати.
За структурою силікати можна поділити на 3 класи:
Мінерали з решітчатою структурою. Вони мають тетраедричну решітчату структуру в основному з ковалентними зв'язками. До мінералів цієї групи належать польові шпати, які складають більше половини маси земної кори:
ортоклаз K2O·Al2O3·6SiO2;
альбіт Na2O·Al2O3·6SiO2;
анортіт CaO·Al2O3·2SiO2.
У мінералах цього типу тетраедрична решітка простягається на весь кристал, надаючи йому твердість та термостійкість.
2.Мінерали з шаруватою структурою. Вони утворюють шари складної будо-ви, які складаються з тетраедрів та октаедрів. До них належать:
тальк 3MgO·4SiO2·H2O;
слюда K2О·3Al2O3·6SiO2·2H2O;
каолініт Al2O3·2SiO2·2H2O.
Тальк та каолініт складаються з електрично нейтральних шарів, що віль-но накладаються один на інший. Такі шари легко ковзаються один відносно одного, чим пояснюються характерні для цих мінералів властивості (мала твердість, сипкість). В слюді, на відміну від перших двох мінералів, шари заряджені негативно і цей заряд нейтралізується розташованими між шарами іонами калію. Електростатична взаємодія між іонами калію та негативно за-рядженими шарами надають слюді деякої твердості. Але іонні зв'язки між шарами більш слабкі, ніж ковалентні зв'язки всередині кожного шару, а тому слюда легко розщеплюється на дуже тоненькі пластини.
3. Мінерали з волокнистою структурою. До мінералів цієї групи належать азбести 3MgO·2SiO2·2H2O. Вони складаються з довгих ланцюгів сполучених між собою тетраедрів. Ланцюги розміщуються паралельно, а тому ці мінерали легко розділяються на волокна, які характеризуються великою міцністю.
На поверхні землі мінерали й гірські породи, що стикаються з атмосфе-рою, зазнають механічних і хімічних дій води й повітря і поступово змінюються та руйнуються. Руйнування, зумовлене одночасною дією води й повітря, називається вивітрюванням. Розкладання польового шпату (ортоклазу) можна виразити рівнянням:
K2O·Al2O3·6SiO2 + CO2 + 2H2O → K2CO3 + Al2O3·2SiO2·2H2O + 4SiO2.
каолініт
Каолініт є головною складовою частиною білої глини. Отже, внаслідок виві-трювання гірських порід утворюються поклади глини, піску та солей.
Використання. Сполуки кремнію відіграють важливу роль у народному господарстві: кремнезем у вигляді піску широко застосовується в будівництві, для виготовлення скла, кераміки. Ряд силікатних порід, наприклад, граніти, застосовуються як будівельні матеріали. Слюду й азбест використовують як електроізоляційні матеріали. З силікатів виготовляють наповнювачі для паперу, гуми, фарб.
Штучні силікати. Зі штучних силікатів найбільше значення мають скло, кераміка, цемент.
Скло. З розплавленого кварцу виготовляють кварцове скло, яке пропускає ультрафіолетове випромінювання і має малий коефіцієнт розширення. Кварцове скло витримує дію високих температур. Його використовують для виготовлення ртутних ламп та лабораторного посуду.
Звичайне віконне або пляшкове скло виробляють, сплавляючи оксид кремнію (IV) у вигляді кварцу або піску з карбонатом кальцію (вапняк, мармур) і карбонатом натрію (сода)
6SiO2 + CaCO3 + Na2CO3 Na2O·CaO·6SiO2 + 2CO2
Якщо замість карбонату натрію взяти карбонат калію (поташ), утвориться міцне тугоплавке скло, яке застосовують для виготовлення хімічного посуду.
Внаслідок сплавлення оксиду кремнію (IV) з поташем та оксидом свинцю (II) PbO одержують кришталь — важке скло, яке дуже заломлює світло.
Якщо частково замінити SiO2 на оксид бору (В2О3), утворюється боро-силікатне скло, яке характеризується більшою стійкістю і меншою чутливістю до різкої зміни температур.
Кольорове скло виготовляють, додаючи до вихідної суміші різні речовини. Невелика кількість оксиду кобальту (II) СоО забарвлює його в синій колір, оксиду хрому (III) Cr2O3 — у зелений, оксиду заліза (II) — у брудно-зелений, оксиду міді (I) Cu2O — у червоний. Внаслідок додавання до вихідної суміші золота утворюється рубінове скло, яке пропускає тільки червоні промені.
Скло стійке до дії води та кислот, але при тривалій дії на звичайне скло вода частково вимиває з поверхні іони натрію. Луги при тривалій дії помітно роз'їдають скло. Плавикова кислота руйнує скло.
Скло має близький коефіцієнт термічного розширення до металів, тому може застосовуватись у збірних конструкціях з металами.
Із скляних волокон виготовляють тканини, які використовують для тепло- та електроізоляції, а також як кислототривкий матеріал.
Розділ 8.
