
- •Л.С.Сухорукова, т.І.Курова, н.І.Мальцева, в.І.Григор’єва,
- •Основи загальної хімії Навчальний посібник
- •Атомно-молекулярне вчення
- •Основні закономірності перебігу хімічних реакцій
- •Розчини. Дисперсні системи
- •Молярна концентрація еквівалента або нормальність (сн) визначається
- •Основи дисоціюють з утворенням катіонів металу і гідроксид-іонів он-:
- •Наприклад, дисоціацію такого індикатора як лакмус, можна описати рівнянням
- •Властивості деяких кислотно-основних індикаторів
- •Ступінь гідролізу визначається співвідношенням:
- •Класифікація дисперсних систем за агрегатним станом дисперсної фази та дисперсійного середовища
- •Зміна механічних властивостей гелю кремнієвої кислоти h2SiO3 при обезводненні
- •Будова речовини
- •Головна підгрупа Побічна група
- •Двох періодів
- •Відносні електронегативності елементів(за шкалою Полінга)
- •2 Відштовхування rзв. Е, кДж/моль
- •Окисно-відновні реакції. Основи електрохімії
- •5.3. Корозія металів. Методи захисту металів від корозії
- •1. Якщо в розчині присутні аніони безкисневих кислот s2-,I-,Br-,Cl- (крім f-) або іони , то відбувається окиснення цих аніонів у послідовності:
- •Неметали
- •Неорганічні в'яжучі речовини
- •Приблизний мінералогічний склад портландцементного клінкеру
- •Характеристики процесів гідратації та продуктів твердіння складових портландцементу
- •Органічні сполуки
- •Найважливіші класи органічних сполук
- •Органічні полімерні матеріали в будівництві
- •Xімія та екологія
Наприклад, дисоціацію такого індикатора як лакмус, можна описати рівнянням
НInd <=>Н+ + Ind-
червоний синій
(кислотна форма) (лужна форма)
У нейтральному середовищі лакмус має фіолетовий колір. При додаванні кислоти рівновага згідно з принципом Ле Шательє зміщується ліворуч і розчин червоніє. В лужному середовищі іони Н+ зв’язуються іонами ОН- у молекули Н2О, внаслідок чого рівновага зміщується праворуч і розчин набуває синього кольору. Аналогічно діють і інші індикатори (метилоранж, фенолфталеїн). Властивості деяких кислотно-основних індикаторів наведені в таблиці 2.
Таблиця 2
Властивості деяких кислотно-основних індикаторів
Індикатор |
Інтервал рН переходу кольору |
Колір |
||
У кислому се-редовищі |
У нейтраль-ному середо-вищі |
У лужному середовищі |
||
Метилоранж |
3.1 - 4.4 |
червоний |
оранжевий |
жовтий |
Лакмус |
5 - 8 |
червоний |
фіолетовий |
синій |
Фенолфталеін |
8.3 - 10 |
безбарвний |
безбарвний |
малиновий |
Буферні розчини. Буферними називаються розчини, рН яких не змінюється при додаванні незначної кількості сильної кислоти або лугу. Буферні розчини містять компоненти, що дисоціюють з утворенням однойменного іона, але відрізняються один від одного ступенем дисоціації. Основні види буферних розчинів: 1) слабка кислота та її сіль: ацетатний (СН3СООН та СН3СООNa), карбонатний (Н2СО3 та NaHCO3); 2) слабка основа та її сіль: амонійний (NH4OH та NH4Cl); 3) дві кислі солі: фосфатний (NaH2PO4 та Na2HPO4); 4) кисла та середня сіль: карбонатний (NaHCO3 та Na2CO3). Постійне значення рН буферних розчинів при додаванні кислоти або лугу пояснюється зв’язуванням введених іонів водню Н+ та гідроксид-іонів ОН компонентами буферного розчину у малодисоційовані сполуки. Так, компоненти карбонатної буферної системи (H2CO3 та NaHCO3) дисоціюють:
H2CO3<=>H+ +HCO3-;
NaHCO3Na+ +HCO3-.
При
введенні в цей розчин кислоти іони Н+
будуть взаємодіяти з іонами НСО![]() з утворенням вугільної кислоти Н2СО3,
тобто рівновага дисоціації ву-гільної
кислоти зміщується ліворуч, а рН розчину
не змінюється.
з утворенням вугільної кислоти Н2СО3,
тобто рівновага дисоціації ву-гільної
кислоти зміщується ліворуч, а рН розчину
не змінюється.
При додаванні до цього буферного розчину невеликої кількості сильної основи, введені іони ОН- взаємодіють з іонами Н+, які утворюються при дисо-ціації вугільної кислоти. Внаслідок цього утворюється малодисоційована спо-
лука — вода. Зниження концентрації іонів Н+ викликає зміщення рівноваги ди-соціації вугільної кислоти праворуч. Це забезпечує постійне значення рН роз-чину.
Константа дисоціації Н2СО3 за першим ступенем має вигляд:

Зважаючи
на незначний ступінь дисоціації вугільної
кислоти можна припустити:![]() Підставляючи введені позна-чення у
вираз константи дисоціації вугільної
кислоти одержуємо:
Підставляючи введені позна-чення у
вираз константи дисоціації вугільної
кислоти одержуємо:
![]()
![]() ,
звідки
,
звідки
Звідси випливає, що величина рН буферного розчину залежить не від концен-трації кислоти та солі, а від співвідношення їхніх концентрацій. Тому при роз-веденні буферного розчину його рН залишається постійним.
Кислотно-основні рівноваги. Вперше теорія кислот та основ була сформульована у 1887р. С. Арреніусом. Згідно з нею кислотами є речовини, що дисоціюють з утворенням водневих іонів, а основами — речовини, що дають при дисоціації гідроксид-іони. Теорія Арреніуса справедлива лише для водних розчинів. Однак, вона не пояснює кислотно-основних властивостей в апротонних розчинниках, не здатних віддавати або приєднувати протон (бензол, ефіри).
Більш повною є протолітична теорія Бренстеда та Лоурі, згідно з якою кислота — це речовина, яка здатна віддавати протон, а основа — речовина, яка здатна приєднувати протон. З цього погляду розчин кислоти або основи у воді є системою, де існує рівновага між двома парами сполучених кислот і основ:






HCl + H2O <=> Cl + H3O+;
кислота1 основа2 основа1 кислота2




NH3 + H2O <=> NH4+ + OH¯.
основа1 кислота2 кислота1 основа2
В апротонних розчинниках кислоти і основи будуть знаходитися в неди-соційованому стані.
Теорія Бренстеда-Лоурі не поширюється на сполуки, які мають виражені ознаки кислот та основ, але нездатні ані приєднувати, ані відщеплювати прото-ни.
Існує також октетна теорія Льюіса, яка визначає кислоту як речовину, здатну приєднувати вільну електронну пару іншої речовини (акцептор електронів), а основу як речовину, що має таку вільну електронну пару (донор електронів).
Ще одна теорія кислотно-основних взаємодій, запропонована М.І. Усано-вичем. Відповідно до цієї теорії кислотами є речовини, здатні віддавати катіони або приєднувати аніони, а також електрони. До основ належать речовини, здат-ні приєднувати катіони або віддавати аніони. Так, в реакції
2Na+Cl2 <=> 2Na++ 2Cl¯
натрій є основою, оскільки віддає електрони, а хлор — кислотою, оскільки приймає цей електрон.
Хоча ці теорії походять з різних передумов, вони не суперечать одна од-ній. Кожна з цих теорій аналізує ті особливості кислотно-основної взаємодії, яких інша теорія не торкається.
3.4. ГІДРОЛІЗ СОЛЕЙ
Гідролізом солей називають реакції обміну між водою і розчиненими в ній солями, що супроводжуються зміною рН середовища внаслідок утворення слабкої кислоти (її кислої солі) або слабкої основи (її основної солі).
Гідроліз солей — це процес, зворотний процесу нейтралізації:
КА + НОН<=>КОН + НА.
сіль основа кислота
Необхідною умовою гідролізу солі є утворення принаймні одного слаб-кого електроліту (кислоти або основи), тому гідролізу зазнають солі, утворені слабкою кислотою і сильною основою або сильною кислотою і слабкою осно-вою. Солі, утворені слабкою кислотою і слабкою основою, гідролізуються най-більш сильно. Іншими словами, гідролізує аніон або катіон слабкого елек-троліту.
1. Гідроліз солі слабкої кислоти і сильної основи (CH3COONa, КCN, Na2CO3, CaS та ін.). У наведених прикладах солей гідролізують аніони слабких кислот:
СН3СОО¯ + НОН<=>СН3СООН + ОН¯;
CN¯ + HOH<=>HCN + OH¯.
На основі скорочених іонних рівнянь легко написати повні іонні рівняння, додавши в обидві частини рівнянь відповідні катіони: для СН3СОО- — це іон Na+, а для CN- — іон К+:
Na+ + CH3COO¯ + HOH<=>CH3COOH + OH¯ + Na+;
К+ + CN¯ + HOH<=>HCN +OH¯ + К+.
У молекулярному вигляді гідроліз цих солей записується рівняннями:
CH3COONa + H2O<=>CH3COOH + NaOH;
КСN + H2O<=>HCN + КОН.
Солі, що містять багатозарядні аніони (СО32-, S2-, SiO32- та ін.) гідролізу-ють ступінчасто (або за стадіями). Наприклад, для карбонатів:
CO32- +HOH<=> HCO3-+OH-;
HCO3-+ HOH<=> H2CO3+OH-.
За першим ступенем гідролізу утворюються кислі іони НСО3- , для яких Кдис.=4,810-11. За другим ступенем гідролізу утворюються молекули Н2СО3, для яких Кдис.=4,510-7. Саме тому за стандартних умов і при незначному розведенні гідроліз іде практично за першим ступенем. Так, для Na2CO3 можна записати:
Na2CO3 + HOH<=>NaOH + NaHCO3;
2Na+ + CO32-+ HOH<=>2Na+ + HCO3- +OH-;
CO32-+ HOH<=> HCO3- +OH-.
Таким чином, для солей слабкої кислоти і сильної основи рівняння гідролізу в загальному вигляді можна записати так:
Ax- +HOH<=>HA(х-1)- +OH-.
Внаслідок гідролізу за аніоном, середовище стає лужним, рН>7.
2. Гідроліз солі сильної кислоти і слабкої основи (NH4Cl, Cu(NO3)2, FeCl3 та ін.).
Причиною гідролізу солей цього типу є утворення слабкої основи або гідроксокатіонів.
У наведених прикладах солей гідролізують катіони слабких основ:
NH4+ + H2O<=>NH4OH + H+;
Cu2+ + H2O<=>CuOH+ + H+;
CuOH+ + H2O<=>Cu(OH)2 + H+.
У молекулярному вигляді гідроліз цих солей записується рівняннями:
NH4Cl + H2O<=>NH4OH + HCl;
Cu(NO3)2 + H2O<=>CuOHNO3 + HNO3;
CuOHNO3 + H2O<=>Cu(OH)2 + HNO3.
У загальному вигляді іонне рівняння процесу гідролізу за катіоном можна записати так:
Kz+ +HOH<=>KOH(z-1)+ +H+.
Внаслідок нагромадження вільних іонів Н+ розчини таких солей є кислими, рН<7.
3. Гідроліз солі слабкої основи і слабкої кислоти (CH3COONH4, Mg(CN)2, Fe2S3 та ін.).
Такі солі гідролізують сильніше попередніх, оскільки продуктами гі-дролізу є два слабких електроліти.
У загальному вигляді рівняння гідролізу за катіоном і аніоном можна за-писати так:
Kz+ +Az- +HOH<=>KOH(z-1)+ +HA(z-1)-.
Для подібних солей не можливо передбачити характер розчину на основі іонного рівняння. Для цього необхідно провести розрахунок на підставі кон-стант дисоціації основи та кислоти, що утворюються.
Більшість солей цієї групи повністю розкладаються водою, тобто відбува-ється необоротний гідроліз. Наприклад:
Fe2S3 + 6H2O 2Fe(OH)3 + 3H2S.
Повний гідроліз проходить у таких випадках, коли обидва продукти гідролізу видаляються з розчину.
Константа і ступінь гідролізу. У загальному вигляді процес гідролізу солі КА, утвореної сильною основою і слабкою кислотою має вигляд:
КА + НОН<=>КОН + НА
або
А + НОН<=>НА + ОН.
 Константу
рівноваги останнього процесу можна
записати у загальному вигляді:
Константу
рівноваги останнього процесу можна
записати у загальному вигляді:
![]() Враховуючи
постійне значення аН2О
в розведених розчинах, зробимо за-міну
К
аН2О=Кг
, тоді
Враховуючи
постійне значення аН2О
в розведених розчинах, зробимо за-міну
К
аН2О=Кг
, тоді
де Кг — константа гідролізу.
Оскільки
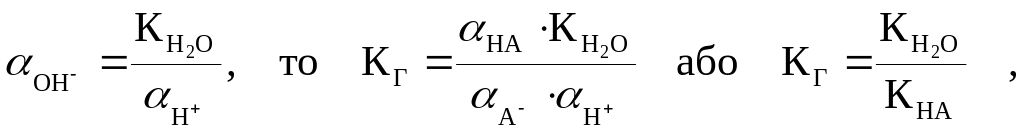
де КН2О — іонний добуток води;
КНА — константа дисоціації слабкої кислоти.
