
- •Часть I
- •Содержание
- •Введение
- •Алканы, алкены, алкины. Способы получения, свойства
- •Получение алканов
- •2. Прямой синтез из элементов
- •Каталитическое гидрирование монооксида углерода
- •Синтезы индивидуальных парафинов
- •Химические свойства алканов
- •Г) Изомеризация, дегидрирование, ароматизация алканов
- •Получение алкенов
- •Химические свойства алкенов
- •Д) Реакции присоединения, протекающие против правила Марковникова
- •E) Окисление алкенов
- •З) Реакции полимеризации алкенов
- •Синтез ацетилена в промышленности, способы введения тройной связи
- •Химические свойства алкинов a) Реакции электрофильного присоединения
- •Б ) Присоединение галогенводородов по тройной связи идет по правилу Марковникова, труднее, чем к алкенам:
- •Д) Реакции с участием подвижного атома водорода в ацетилене
- •Е) Окисление ацетилена
- •В избытке окислителя может происходить полное разрушение молекулы алкина:
- •Ж) Димеризация и полимеризация ацетилена проходят каталитически.
- •Практическая работа № 1 получение и свойства метана, алкенов и ацетилена
- •2. Получение и исследование некоторых свойств алкенов
- •3. Получение ацетилена и исследование его свойств
- •Контрольные вопросы и задания
- •Реакции электрофильного замещения в ароматических соединениях
- •Типы электрофильных реагентов. Пути их образования
- •Эффекты замещения. Ориентанты I и II рода. Индуктивное и мезомерное влияние заместителей
- •Согласованная и несогласованная ориентация заместителей
- •Практическая работа № 2 свойства ароматических соединений получение мета-динитробензола
- •1. Окисление ароматических углеводородов
- •2. Качественная реакция на ароматические углеводороды
- •3. Синтез мета-динитробензола
- •Контрольные вопросы и задания
- •Реакции аренов, приводящие к неароматическим системам. Окислительные превращения
- •Практическая работа № 3 получение бензойной кислоты окислением арена
- •Контрольные вопросы и задания
- •Способы очистки твердых органических соединеий
- •Практическая работа № 4 очистка бензойной кислоты методом перекристаллизации, определение температуры плавления
- •1. Перекристаллизация
- •2. Определение температуры плавления
- •Контрольные вопросы и задания
- •Способы получения галогенпроизводных предельных углеводородов. Реакции нуклеофильного замещения
- •Практическая работа № 5 синтез бромистого алкила
- •1. Синтез бромистого алкила
- •2. Очистка вещества перегонкой при атмосферном давлении
- •Контрольные вопросы и задания
- •Правила техники безопасности при выполнении работ
- •Литература
- •Часть I
- •603950, Нижний Новгород, пр. Гагарина, 23
Е) Окисление ацетилена
Алкины, подобно алкенам, могут подвергаться окислению по тройной связи. Продуктами окисления являются соответствующие карбоновые кислоты, в качестве окислителей применяют KMnO4, озон и т.д.:
KMnO4
CH3-CH2-CC-CH2-CH3 2 CH3-CH2-COOH
25 C, OH
Алкины быстро обесцвечивают раствор KMnO4, что может использоваться как качественная реакция на тройную связь:
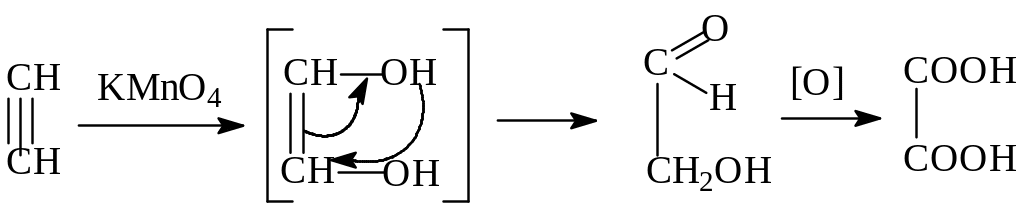
В избытке окислителя может происходить полное разрушение молекулы алкина:
3 HCCH + 10 KMnO4 + 2 H2O 6 СО2 + 10 MnO2 + 10 KOH
Ж) Димеризация и полимеризация ацетилена проходят каталитически.
При пропускании ацетилена в кислый водный раствор CuCl в хлориде аммония ацетилен линейно димеризуется в винилацетилен, который используется для синтеза хлоропрена:
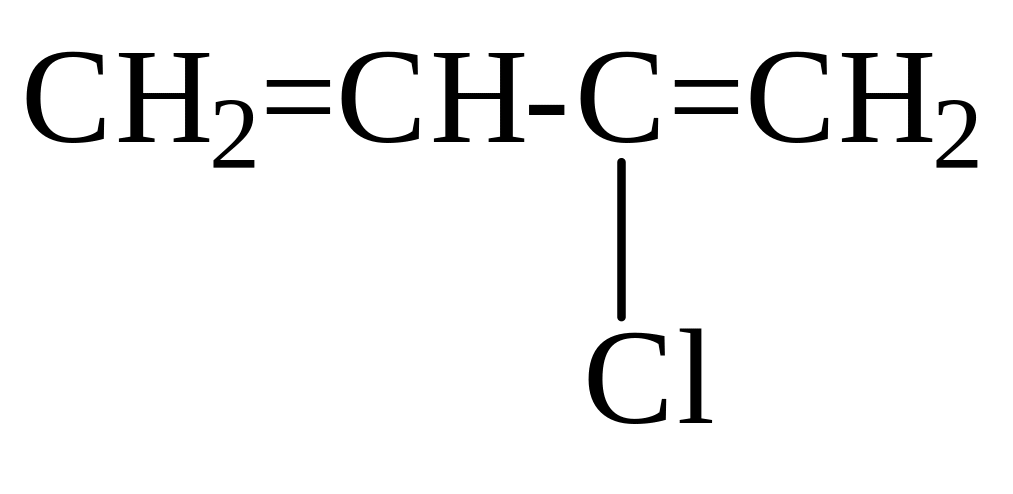 CuCl
HCl
CuCl
HCl
НССН + НССН H2C=CH-CCH
NH4OH
хлоропрен
Тримеризация ацетилена (Н.Д. Зелинский, Б.А. Казанский) приводит к бензолу c выходом 60-70 %:
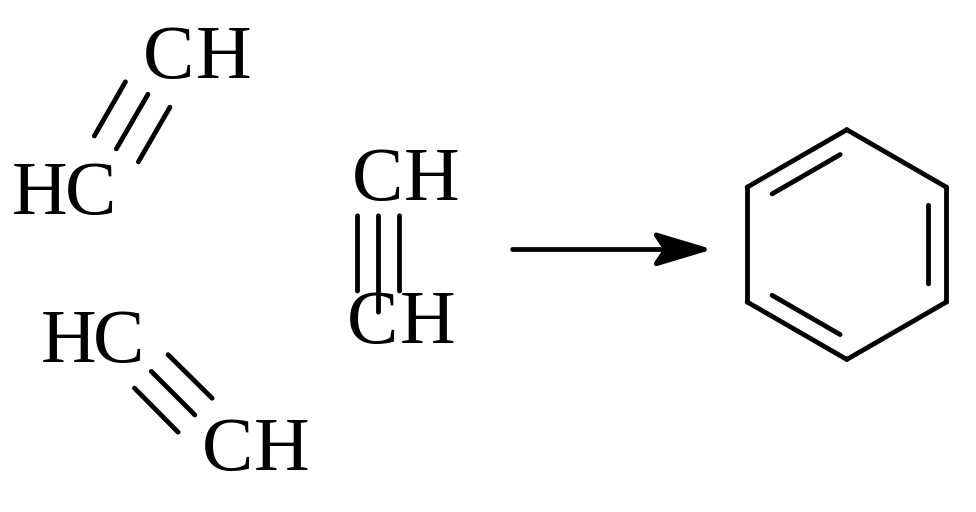
500 С
+
С(акт.)
Ацетилен легко превращается в полимер – купрен в присутствии металлической меди, следов кислорода:
Cu
n CHCH (C2H2)n
Реакция проходит при температуре 200-250 С
Практическая работа № 1 получение и свойства метана, алкенов и ацетилена
Цель работы: изучение некоторых свойств ациклических углеводородов различного строения
Оборудование: штатив с пробирками, газовая горелка, держатель для пробирок, газоотводная трубка, стеклянные палочки, кипелки, фильтровальная бумага.
Получение метана и исследование его реакционной способности
В сухую пробирку помещают смесь безводного ацетата натрия с натронной известью (смесь СаО и NaOH) в соотношении 1 : 2 слоем 2-3 см. Пробирку закрывают пробкой с газоотводной трубкой, поддерживают ее горизонтально держателем для пробирок и нагревают в пламени горелки.
Выделяющийся метан поджигают у конца газоотводной трубки и наблюдают за цветом пламени.
Затем, не прекращая нагревание, пропускают выделяющийся газ в предварительно приготовленные пробирки с бромной водой и водным раствором перманганата калия. Отмечают наблюдаемые явления.
2. Получение и исследование некоторых свойств алкенов
В сухой пробирке смешивают 1 мл этилового (или изопропилового) спирта и 3 мл концентрированной серной кислоты, осторожно приливая кислоту к спирту. Затем добавляют несколько крупинок оксида алюминия и 1-2 кипелки (кусочки битого фарфора). Пробирку закрывают пробкой с газоотводной трубкой.
Прежде чем нагревать реакционную смесь, готовят две пробирки: в одну наливают бромную воду, в другую – водный раствор перманганата калия. Можно использовать пробирки с указанными растворами, оставшиеся от предыдущего опыта!
Пробирку поддерживают наклонно держателем для пробирок и осторожно нагревают в пламени горелки до начала равномерного выделения газа. Газоотводную трубку поочередно помещают в приготовленные растворы. При этом наблюдают изменение окраски раствора перманганата калия от малиновой до бурой.
Бромная вода обесцвечивается.
