
- •Часть I
- •Содержание
- •Введение
- •Алканы, алкены, алкины. Способы получения, свойства
- •Получение алканов
- •2. Прямой синтез из элементов
- •Каталитическое гидрирование монооксида углерода
- •Синтезы индивидуальных парафинов
- •Химические свойства алканов
- •Г) Изомеризация, дегидрирование, ароматизация алканов
- •Получение алкенов
- •Химические свойства алкенов
- •Д) Реакции присоединения, протекающие против правила Марковникова
- •E) Окисление алкенов
- •З) Реакции полимеризации алкенов
- •Синтез ацетилена в промышленности, способы введения тройной связи
- •Химические свойства алкинов a) Реакции электрофильного присоединения
- •Б ) Присоединение галогенводородов по тройной связи идет по правилу Марковникова, труднее, чем к алкенам:
- •Д) Реакции с участием подвижного атома водорода в ацетилене
- •Е) Окисление ацетилена
- •В избытке окислителя может происходить полное разрушение молекулы алкина:
- •Ж) Димеризация и полимеризация ацетилена проходят каталитически.
- •Практическая работа № 1 получение и свойства метана, алкенов и ацетилена
- •2. Получение и исследование некоторых свойств алкенов
- •3. Получение ацетилена и исследование его свойств
- •Контрольные вопросы и задания
- •Реакции электрофильного замещения в ароматических соединениях
- •Типы электрофильных реагентов. Пути их образования
- •Эффекты замещения. Ориентанты I и II рода. Индуктивное и мезомерное влияние заместителей
- •Согласованная и несогласованная ориентация заместителей
- •Практическая работа № 2 свойства ароматических соединений получение мета-динитробензола
- •1. Окисление ароматических углеводородов
- •2. Качественная реакция на ароматические углеводороды
- •3. Синтез мета-динитробензола
- •Контрольные вопросы и задания
- •Реакции аренов, приводящие к неароматическим системам. Окислительные превращения
- •Практическая работа № 3 получение бензойной кислоты окислением арена
- •Контрольные вопросы и задания
- •Способы очистки твердых органических соединеий
- •Практическая работа № 4 очистка бензойной кислоты методом перекристаллизации, определение температуры плавления
- •1. Перекристаллизация
- •2. Определение температуры плавления
- •Контрольные вопросы и задания
- •Способы получения галогенпроизводных предельных углеводородов. Реакции нуклеофильного замещения
- •Практическая работа № 5 синтез бромистого алкила
- •1. Синтез бромистого алкила
- •2. Очистка вещества перегонкой при атмосферном давлении
- •Контрольные вопросы и задания
- •Правила техники безопасности при выполнении работ
- •Литература
- •Часть I
- •603950, Нижний Новгород, пр. Гагарина, 23
Химические свойства алканов
Реакции, в которые наиболее легко вступают парафины – радикальные реакции замещения, идущие в довольно жестких условиях (действие света, высокой температуры и др.).
а) Галогенирование алканов
Например, xлорирование алканов ускоряется светом, добавками пероксидов. Механизм хлорирования:
hv
Зарождение цепи: Cl2 Cl + Cl
CH4 + Cl HCl + CH3 - метилрадикал
2. Рост цепи: CH3 + Cl2 CH3Cl + Cl
CH4 + Cl HCl + CH3 и т.д.
По мере накопления хлорметана, возможна цепь реакций, приводящая к CH2Cl2, CHCl3 и CCl4. Смесь разделяют ректификацией. При хлорировании высших алканов получается трудноразделимая смесь продуктов, поэтому в промышленности этот способ не используется.
3. Обрыв цепи: CH3 + CH3 CH3CH3
CH3 + Cl CH3Cl
Бромирование также проходит по радикальному механизму, но первая стадия роста цепи сильно экзотермична (H = - 100 кДж/моль). Напротив, эндотермичность первой стадии роста цепи при йодировании алканов (~130 кДж/моль) делает ее практически неосуществимой даже при температуре порядка 300 С.
Прямое фторирование алканов не применяется вследствие высокой экзотермичности, реакции идут с взрывом: CH4 + 4 F2 CF4 + 4 HF
Х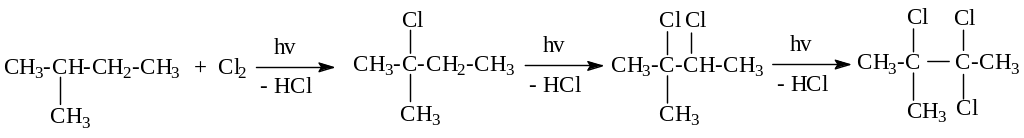 имические
реакции всегда идут в сторону образования
более стабильной частицы. При
галогенировании более сложных по
строению алканов положение замещения
определяется устойчивостью
образующегося алкильного радикала.
Это показал еще Марковников на примере
хлорирования изопентана:
имические
реакции всегда идут в сторону образования
более стабильной частицы. При
галогенировании более сложных по
строению алканов положение замещения
определяется устойчивостью
образующегося алкильного радикала.
Это показал еще Марковников на примере
хлорирования изопентана:
Cамым стабильным в данном случае является трет-пентильный радикал
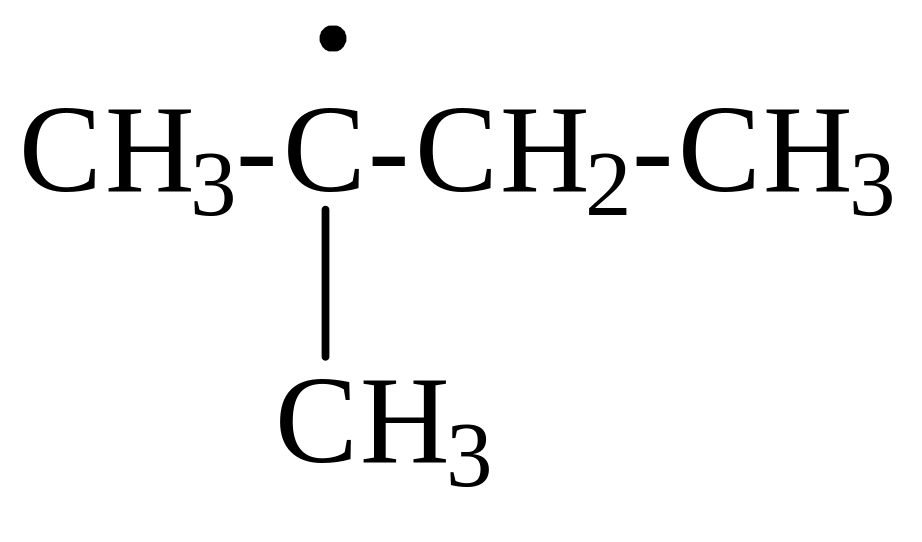
, поэтому и в качестве первого продукта хлорирования
получается трет-пентилхлорид.
Радикальный механизм имеет место также в реакциях нитрования, сульфохлорирования.
б) Окисление
Парафины при обычной температуре устойчивы к действию кислорода и обычных окислителей. При глубоком воздействии (горении) получается СО2 и Н2О:
С3Н8 + 5 О2 3 СО2 + 4 Н2О
Кислород воздуха и обычные окислители (KMnO4, K2CrO4, K2Cr2O7 и др.) окисляют алканы при высоких температурах с разрывом связи С-С и образованием преимущественно кислот.
Окисление также протекает по свободно-радикальному механизму.
в) Термическое разложение алканов (пиролиз, крекинг)
Метан не разлагается до 800 С, другие углеводороды стабильны до 300 С. Нагревание до 400-600 С сообщает молекулам алканов достаточно энергии для того, чтобы произошел гомолитический разрыв С-С связей – крекинг (to crаck).
При крекинге предельных углеводородов образуются более простые ненасыщенные или насыщенные углеводороды:
CH3-CH2-CH2-CH3 C2H6 + C2H4
Крекинг углеводородов может быть проведен как чисто термически, так и в присутствии катализаторов. Термическое расщепление происходит по радикальному механизму, а каталитическое преимущественно через карбониевые ионы.
При 650-700 С идет более глубокий распад – пиролиз, который дает много водорода, углистого остатка (кокса), простейших углеводородов (С2Н4, С3Н6 –до 20 %) и ароматические углеводороды.
