
- •Часть I
- •Содержание
- •Введение
- •Алканы, алкены, алкины. Способы получения, свойства
- •Получение алканов
- •2. Прямой синтез из элементов
- •Каталитическое гидрирование монооксида углерода
- •Синтезы индивидуальных парафинов
- •Химические свойства алканов
- •Г) Изомеризация, дегидрирование, ароматизация алканов
- •Получение алкенов
- •Химические свойства алкенов
- •Д) Реакции присоединения, протекающие против правила Марковникова
- •E) Окисление алкенов
- •З) Реакции полимеризации алкенов
- •Синтез ацетилена в промышленности, способы введения тройной связи
- •Химические свойства алкинов a) Реакции электрофильного присоединения
- •Б ) Присоединение галогенводородов по тройной связи идет по правилу Марковникова, труднее, чем к алкенам:
- •Д) Реакции с участием подвижного атома водорода в ацетилене
- •Е) Окисление ацетилена
- •В избытке окислителя может происходить полное разрушение молекулы алкина:
- •Ж) Димеризация и полимеризация ацетилена проходят каталитически.
- •Практическая работа № 1 получение и свойства метана, алкенов и ацетилена
- •2. Получение и исследование некоторых свойств алкенов
- •3. Получение ацетилена и исследование его свойств
- •Контрольные вопросы и задания
- •Реакции электрофильного замещения в ароматических соединениях
- •Типы электрофильных реагентов. Пути их образования
- •Эффекты замещения. Ориентанты I и II рода. Индуктивное и мезомерное влияние заместителей
- •Согласованная и несогласованная ориентация заместителей
- •Практическая работа № 2 свойства ароматических соединений получение мета-динитробензола
- •1. Окисление ароматических углеводородов
- •2. Качественная реакция на ароматические углеводороды
- •3. Синтез мета-динитробензола
- •Контрольные вопросы и задания
- •Реакции аренов, приводящие к неароматическим системам. Окислительные превращения
- •Практическая работа № 3 получение бензойной кислоты окислением арена
- •Контрольные вопросы и задания
- •Способы очистки твердых органических соединеий
- •Практическая работа № 4 очистка бензойной кислоты методом перекристаллизации, определение температуры плавления
- •1. Перекристаллизация
- •2. Определение температуры плавления
- •Контрольные вопросы и задания
- •Способы получения галогенпроизводных предельных углеводородов. Реакции нуклеофильного замещения
- •Практическая работа № 5 синтез бромистого алкила
- •1. Синтез бромистого алкила
- •2. Очистка вещества перегонкой при атмосферном давлении
- •Контрольные вопросы и задания
- •Правила техники безопасности при выполнении работ
- •Литература
- •Часть I
- •603950, Нижний Новгород, пр. Гагарина, 23
2. Определение температуры плавления
Для определения температуры плавления органического соединения используют прибор, изображенный на рисунке:
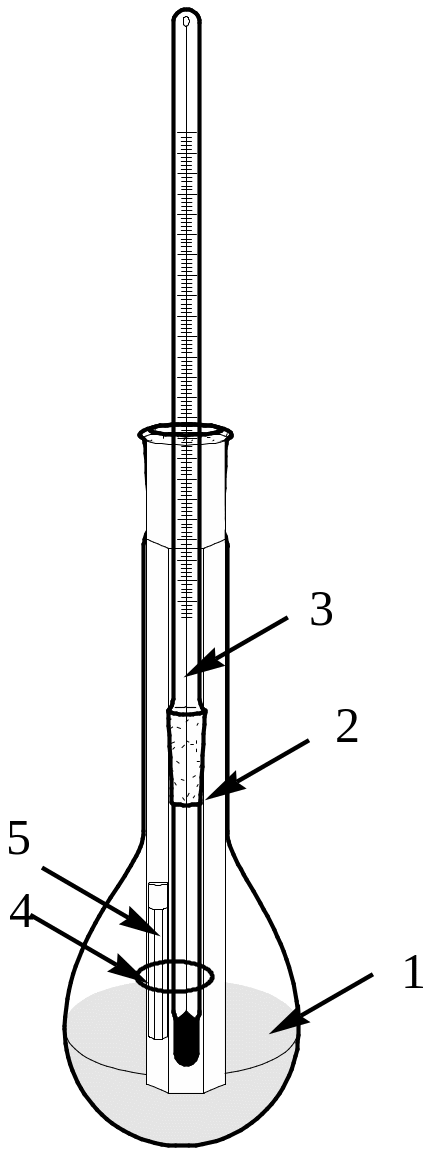
1 – заполненная высококипящей
жидкостью либо пустая колба
2 – стеклянная пробирка
3 – термометр
4 – резиновое кольцо
5 – капилляр с веществом
Небольшое количество вещества тщательно растирают в тонкий порошок. Затем берут стеклянный капилляр, запаянный с одного конца. Открытым концом капилляра зачерпывают часть мелко растертого вещества и перемещают его к запаянному концу капилляра легким встряхиванием или постукиванием запаянной частью по твердой поверхности. Кроме того, для уплотнения вещества в капилляре можно несколько раз пробросить его через стеклянную трубку длиной 70-80 см, укрепленную вертикально на твердой поверхности.
Капилляр заполняют веществом на 3-4 мм, закрепляют его с помощью резинового кольца на уровне ртутного столбика термометра и помещают в прибор. Прибор медленно нагревают на газовой горелке, снабженной рассекателем, внимательно следя за состоянием вещества в капилляре. Отмечают температурный интервал от начала слипания порошка в капилляре до окончательного расплава. Затем берут новый капилляр с веществом и повторяют определение температуры плавления до получения сходных результатов.
Чистое вещество плавится в диапазоне 0.5 – 1 С.
Контрольные вопросы и задания
Какой способ очистки – возгонка или перекристаллизация - по вашему мнению предпочтительнее для твердых органических соединений? Почему?
Твердое органическое вещество – ацетанилид имеет температуру плавления 114 С. Какой растворитель из нижеперечисленных будет наиболее оптимальным для перекристаллизации ацетанилида: пентан (т.кип. 34 С), вода (т.кип. 100 С), метанол (т.кип. 65 С). Ответ поясните.
Если вещество недостаточно очищено, температура плавления такого соединения будет выше или ниже справочных данных. Почему?
Способы получения галогенпроизводных предельных углеводородов. Реакции нуклеофильного замещения
Галогенуглеводороды – это производные углеводородов, получающиеся при замене одиного или нескольких атомов водорода на атомы галогенов. Различают (Х = F, Cl, Br, I):
1. Галогеналканы: CnH2n+1X, C2H5Br – бромэтан (бромистый этил, этилбромид )
2. Галогеналкены: CnH2n-1X, CН2=СН-Cl – хлорэтен (винилхлорид, хлористый винил)
3. Галогеналкины: CnH2n-3X, CНС-Cl - хлористый этинил
4. Галогенарены С6Н5X, C6H5-I - йодбензол
Рассмотрим способы синтеза и некоторые химические свойства галогеналканов. При их синтезе обычно исходят из углеводородов, спиртов или карбоновых кислот. Следует заметить, что способы введения в молекулу таких галогенов, как хлор, бром и йод непригодны для получения фторпроизводных.
а) Галогенирование предельных углеводородов.
Радикальным галогенированием алканов можно получить хлор- или бромалканы. Примером может служить хлорирование метана, механизм которого подробно разобран ранее:
hv hv hv hv
СН4 + Cl2 CH3Cl CH2Cl2 CHCl3 CCl4
– HCl – HCl – HCl – HCl
Недостатком этого метода является образование смеси различных продуктов замещения, когда наряду с изомерными монозамещенными производными, в смеси содержатся ди-, три- и полигалогензамещенные соединения. Изменяя условия ведения процесса, в промышленности при хлорировании метана можно получать в качестве основного продукта любое из указанных веществ. Отделение побочных продуктов осуществляют фракционной перегонкой.
Активность галогенов падает в ряду: фтор (реагирует со взрывом), хлор, бром, йод.
Монойодалканы получают по реакции обмена между соответствующим хлорпроизводным и NaI или КI в ацетоне (реакция Финкельштайна):
(СН3)2СНCl + KI (СН3)2СНI + KCl
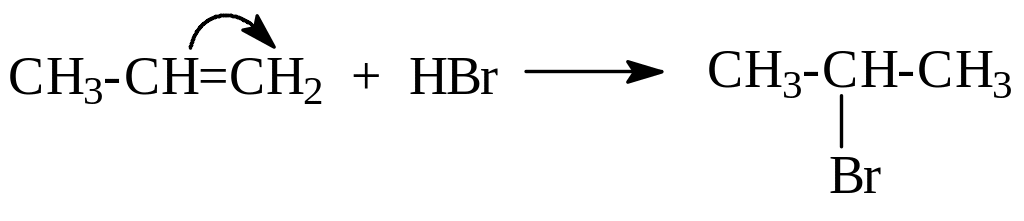
б) Галогеналканы можно получать по реакции присоединения галогенов и галогенводородов к алкенам:
CH2=CH2 + Br2 CH2BrCH2Br
Галогенводороды присоединяются по правилу Марковникова:
 + -
+
-
+ -
+
-
Реакционная способность галогенводородов растет в ряду: HF < HCl < HBr < HI.
в) Получение галогенуглеводородов из спиртов
1. Реакции проходят по общей схеме:
![]() R-OH
+ HX
RX
+ H2O
R-OH
+ HX
RX
+ H2O
Этот метод, имеющий как промышленное, так и лабораторное значение, пригоден для получения хлор-, бром- и йодалканов. Скорость реакции зависит от строения спирта и природы галогенводорода. Реакционная способность падает в ряду: HI > HBr > HCl, а также в ряду: третичный спирт > вторичный спирт > первичный спирт.
Mеханизм - нуклеофильноe замещениe. Реакция обратима и преимущественное ее направление зависит от концентрации воды. Реакция проходит со значительной скоростью только в присутствии сильных кислот. Спирт присоединяет протон кислоты, образуя ион алкилоксония:
H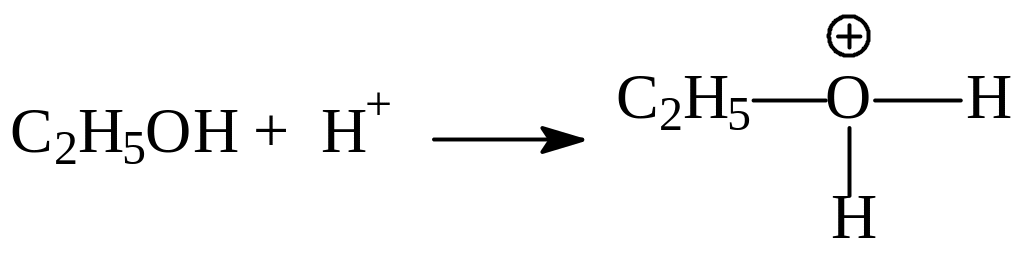 Br
H+
+ Br-
Br
H+
+ Br-
ион этилоксония
Ионы алкилоксония более активны при последующем замещении на бромид-ион, чем спирт, так как отрыв от него нейтральной молекулы воды происходит легче, чем отрыв гидроксил-иона от спирта.
2. Спирты можно перевести в галогеналканы при обработке хлоридами трех- и пятивалентного фосфора, тионилхлоридом, а также соответствующими бромидами. При этом легче всего реагируют первичные спирты:
3 ROH + PBr3 3 RBr + P(OH)3
ROH + PBr5 RBr + HBr + POBr3
трибромокcид фосфора
ROH + SOCl2 RCl + SO2 + HCl
Последняя реакция удобна, так как образующиеся побочные компоненты являются газообразными веществами.
Для получения йодпроизводных используют спирт, свободный йод и красный фосфор:
3 I2 + 2 P 2 PI3
3 ROH + PI3 3 RI + H3PO3
г) Синтез галогеналканов из карбоновых кислот осуществляется по реакции Бородина-Хунсдикера при обработке серебряных солей карбоновых кислот в растворе CCl4 хлором или бромом, а при определенных условиях и йодом:
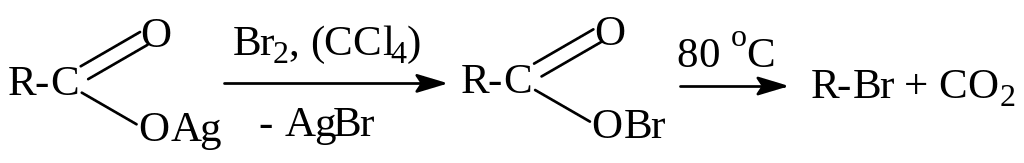
Реакция проходит по радикальному механизму.
Химические свойства галогеналканов (СnH2n+1X)
Галогенуглеводороды имеют важное значение, поскольку они в большинстве своем относительно доступны и, вследствие своей высокой реакционной способности, служат ценными исходными продуктами для синтеза соединений других классов.
Углеводородная цепь галогеналканов сохраняет свойства цепи алканов. Hаиболее важным типом реакций галогеналканов являются реакции замещения – обмен атома галогена на другие галогены или другие одновалентные группы атомов при действии H2O, оснований, солей; известно огромное число реакций такого типа.
а) При действии водного раствора щелочи или влажного оксида серебра на галогеналканы образуются спирты:
R X + NaOH(водн.) ROH + NaX
RCl + Ag2O(вл.) ROH + AgCl
б) B pеакции RX с алкоголятами получаются простые эфиры:
C2H5Br + C2H5ONa C2H5OC2H5 + NaBr
в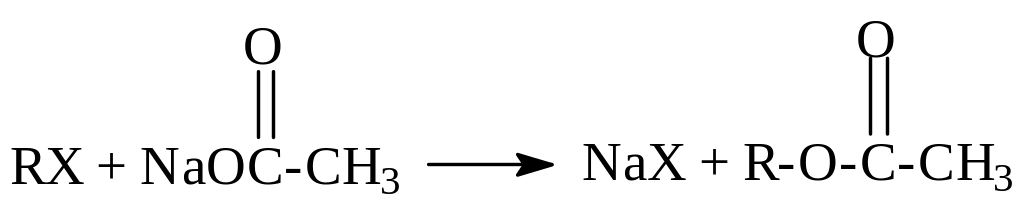 )
Соли
карбоновых кислот дают
сложные эфиры:
)
Соли
карбоновых кислот дают
сложные эфиры:
г) При действии на галогеналкилы цианидов образуются нитрилы:
СН3I + KCN CH3-CN + KI
ацетонитрил
(нитрил уксусной кислоты)
д) Нитрит серебра превращает галогеналканы в нитросоединения:
CH3-CH2-I + AgNO2 AgI + CH3CH2NO2
е) Взаимодействие RX с аммиаком приводит к образованию аминов:
CH3I + 2 NH3 CH3NH2 + NH4I
метиламин
Формально все эти превращения напоминают ионный обмен:
Такие реакции называют реакциями нуклеофильного замещения и условно обозначают SN (англ. Substitution – замещение, Nucleophilic – нуклеофильное).
Механизм реакции нуклеофильного замещения и реакционная способность галогенпроизводных зависят от природы галогена и углеводородного радикала, связанного с галогеном, от характера реагента, природы растворителя и условий реакции – температуры, катализатора и др.
