
- •Часть I
- •Содержание
- •Введение
- •Алканы, алкены, алкины. Способы получения, свойства
- •Получение алканов
- •2. Прямой синтез из элементов
- •Каталитическое гидрирование монооксида углерода
- •Синтезы индивидуальных парафинов
- •Химические свойства алканов
- •Г) Изомеризация, дегидрирование, ароматизация алканов
- •Получение алкенов
- •Химические свойства алкенов
- •Д) Реакции присоединения, протекающие против правила Марковникова
- •E) Окисление алкенов
- •З) Реакции полимеризации алкенов
- •Синтез ацетилена в промышленности, способы введения тройной связи
- •Химические свойства алкинов a) Реакции электрофильного присоединения
- •Б ) Присоединение галогенводородов по тройной связи идет по правилу Марковникова, труднее, чем к алкенам:
- •Д) Реакции с участием подвижного атома водорода в ацетилене
- •Е) Окисление ацетилена
- •В избытке окислителя может происходить полное разрушение молекулы алкина:
- •Ж) Димеризация и полимеризация ацетилена проходят каталитически.
- •Практическая работа № 1 получение и свойства метана, алкенов и ацетилена
- •2. Получение и исследование некоторых свойств алкенов
- •3. Получение ацетилена и исследование его свойств
- •Контрольные вопросы и задания
- •Реакции электрофильного замещения в ароматических соединениях
- •Типы электрофильных реагентов. Пути их образования
- •Эффекты замещения. Ориентанты I и II рода. Индуктивное и мезомерное влияние заместителей
- •Согласованная и несогласованная ориентация заместителей
- •Практическая работа № 2 свойства ароматических соединений получение мета-динитробензола
- •1. Окисление ароматических углеводородов
- •2. Качественная реакция на ароматические углеводороды
- •3. Синтез мета-динитробензола
- •Контрольные вопросы и задания
- •Реакции аренов, приводящие к неароматическим системам. Окислительные превращения
- •Практическая работа № 3 получение бензойной кислоты окислением арена
- •Контрольные вопросы и задания
- •Способы очистки твердых органических соединеий
- •Практическая работа № 4 очистка бензойной кислоты методом перекристаллизации, определение температуры плавления
- •1. Перекристаллизация
- •2. Определение температуры плавления
- •Контрольные вопросы и задания
- •Способы получения галогенпроизводных предельных углеводородов. Реакции нуклеофильного замещения
- •Практическая работа № 5 синтез бромистого алкила
- •1. Синтез бромистого алкила
- •2. Очистка вещества перегонкой при атмосферном давлении
- •Контрольные вопросы и задания
- •Правила техники безопасности при выполнении работ
- •Литература
- •Часть I
- •603950, Нижний Новгород, пр. Гагарина, 23
Алканы, алкены, алкины. Способы получения, свойства
В основу классификации органических соединений положен класс углеводородов, веществ, состоящих только из атомов углерода и водорода. Все остальные соединения рассматриваются как их производные, образовавшиеся при замене в углеводородах одного или нескольких атомов водорода на другие атомы, радикалы или функциональные группы.
Первым классом углеводородов являются предельные нециклические углеводороды, называемые также алканами или парафинами. Это соединения общей формулы СnH2n+2, с открытой цепью, содержащие только простые ковалентные связи.
Получение алканов
1. Основные и наиболее важные источники предельных углеводородов состава от С1 до С30-С40 – нефть, природный газ, а также каменный уголь. Газовые месторождения содержат 93-99 % метана, 0.2-0.6 % этана, 0.08-0.1 % пропана и 0.1-0.3 % высших углеводородов. В природе встречаются и отдельные залежи твердых парафиновых углеводородов в виде горного воска или озокерита.
Важнейшим источником органических веществ является нефть, которая представляет собой смесь органических веществ, главным образом, углеводородов различных классов. Обычная переработка нефти заключается в ее перегонке, то есть разделении на фракции, различающиеся по температуре кипения.
2. Прямой синтез из элементов
Метан образуется в небольших количествах вместе с ацетиленом и другими углеводородами в пламени электрической дуги между угольными электродами. В присутствии катализаторов (Ni, покрытый тонким слоем угля) реакция идет при более низкой температуре:

В этих условиях образуется до 97 % метана.
Каталитическое гидрирование монооксида углерода
Ni, 250-300 С
СО + 3 Н2 CH4 + H2O
Эту реакцию можно проводить так, что вместо СН4 получится смесь углеводородов - синтетический бензин – метод Фишера-Тропша. В общем виде:
n СО + (2n + 1) Н2 CnH2n+2 + n H2O
Синтезы индивидуальных парафинов
а) Восстановление алкилгалогенидов, спиртов, непредельных соединений.
Сильным восстановителем органических соединений является йодистоводородная кислота (Бертло, 1868 г.), вследствие ее способности разлагаться на водород и йод: 2 HI H2 + I2.
CH3I + HI CH4 + I2
C2H5OH + 2 HI C2H6 + H2O + I2
Наиболее важным промышленным способом является каталитическое гидрирование непредельных соединений.
Ni
R-CH=CH2 + H2 R-CH2-CH3
Ацетиленовые углеводороды также гидрируются до алканов; катализаторы: Ni, Pt, Pd, t > 100 C, гетерогенный катализ.
б) Гидролиз реактивов Гриньяра
При прибавлении раствора RX, где R - углеводородный радикал, Х – галоген, в сухом диэтиловом эфире к металлическому магнию при перемешивании происходит бурная реакция, сопровождающаяся растворением магния. Получающийся эфирный раствор магнийорганического вещества называется реактивом Гриньяра. Например:
эфир
C2H5Br + Mg C2H5MgBr – этилмагнийбромид
Гидролиз реактивов Гриньяра приводит к алканам:
C2H5MgBr + Н-ОН C2H6 + Mg(OH)Br
этан
в) Большое значение для синтеза парафинов имеет реакция Вюрца (1855 г.), основанная на отщеплении галогенов от галогенуглеводородов при действии металлического натрия:
R-X + 2 Na + X-R 2 NaX + R-R
Синтез Вюрца пригоден для получения симметрично-построенных алканов.
г) Электролиз солей одноосновных карбоновых кислот (метод Кольбе, 1849 г.)
Под влиянием электрического тока ионы металла (чаще натрия) движутся к катоду, а отрицательно заряженные остатки органической кислоты – к аноду, где они окисляются с образованием СО2 и алкана. На катоде происходит восстановление воды с выделением водорода (если соль образована активным металлом).
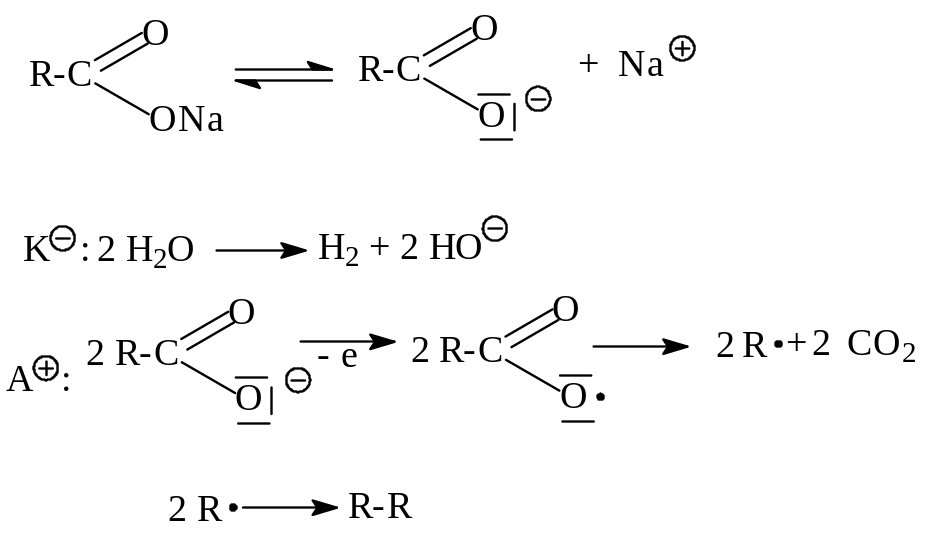
д) Сплавление солей одноосновных карбоновых кислот со щелочами.
Т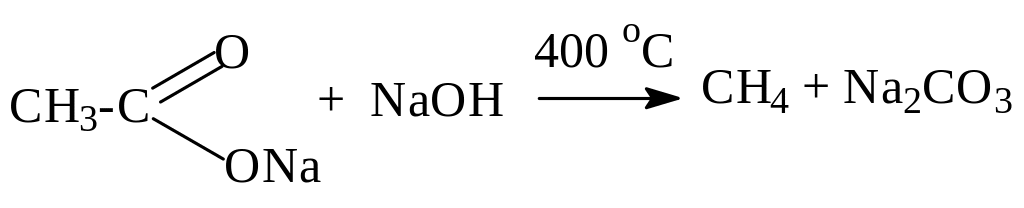 вердую
соль щелочного металла сплавляют с
твердым гидроксидом натрия, при этом
карбоксильная группа выделяется в виде
карбоната:
вердую
соль щелочного металла сплавляют с
твердым гидроксидом натрия, при этом
карбоксильная группа выделяется в виде
карбоната:
Образующийся углеводород содержит на 1 атом углерода меньше, чем в исходной кислоте.
