
- •Внутренняя энергия и энтальпия. 1 закон термодинамики. Термодинамические расчеты.
- •2) Энтропия, ее изменения при фазовых переходах и химических процессах. 2 и 3 законы термодинамики.
- •3) Энергия Гиббса. Термодинамическая оценка возможности реакций.
- •4) Понятия о химическом потенциале. Направление протекания процессов.
- •5) Химическое в гомогенных системах.
- •6) Константа равновесия. Зависимость константы равновесия от температуры.
- •7) Равновесие в гетерогенных системах.
- •8) Понятие скорости реакции.
- •9) Зависимость скорости реакции от концентрации реагентов. Закон действующих масс.
- •10) Температурная зависимость константы скорости.
- •11) Теория переходного состояния. Энергия активации. Суть теории переходного состояния (активированного комплекса):
- •13) Диффузия. Законы Фика.
- •12) Механизм и кинетика взаимодействия компонентов в гомогенных газообразных средах. Молекулярность и порядок реакций.
- •14) Особенности диффузионных процессов в твердых телах.
- •15) Влияние дефектов структуры на процесс диффузии. Кристаллизация сплавов. Процессы образования и роста зародышей новой фазы.
- •17) Правило фаз Гиббса.
- •19) Виды взаимодей-я компонентов в сплавах.
- •18) Условия равновесия фаз. Виды фазовых превращений.
- •21) Диаграмма состояния сплавов, образующих неограниченные твердые растворы.
- •23) Перитектическая кристаллизация, перитектоидное превращение.
- •22) Диаграмма состояния сплавов, образующих ограниченные твердые растворы.
- •27) Магнитное превращение.
- •24) Количественных расчет по диаграммам состояния. Правило отрезков.
- •25) Правило Курнакова. Связь между типом диаграммы состояния и свойствами сплавов.
- •26) Полиморфные превращения.
- •28) Особенности мартенситного превращения.
- •29) Распад пересыщенного твердого раствора. Процессы старения.
- •30) Спиноидальный распад.
- •31) Упорядочение атомов.
- •32) Понятие об адсорбции. Физическая адсорбция и хемосорбция.
- •34) Особенности адсорбции из растворов.
- •35) Поверхностно-активные вещества.
- •33) Изотермы адсорбции.
- •36) Явление смачивания.
- •37) Растворы. Парциальные мольные величины.
- •38) Совершенные растворы. Реальные растворы. Активность.
- •39) Равновесие в системе "жидкость - пар". Закон Рауля.
- •40) Закон распределения. Экстракция.
- •41) Теоретические основы процессов дистилляции, сублимации, ректификации металлов и их соединений.
- •42) Физико-химич. Основы зонной плавки.
- •43) Км. Общее понятие и классификация.
- •45) Межфазное взаимодействие в композиционных материалах. Выбор материала матриц и волокон.
17) Правило фаз Гиббса.
Правило фаз Гиббса — соотношение, связывающее число веществ (компонентов), фаз и степеней свободы в гетерогенной системе. С=к+2+Ф. где С – число степеней свободы, к – компонент, Ф – фаза. Например для точки (1) С=1+2-1=2 значит система бивариантная, т (2) С=1+2-2=1 моновариантна, т (0) С =1+2-3=0 нонвариантна.
19) Виды взаимодей-я компонентов в сплавах.
1)Замещение – фазы, в которых часть узлов кристаллической решетки заполнены атомами одного сорта, а часть атомами другого сорта.
2)Внедрение – фазы, в которых атомы растворенного компонента внедрены между атомами второго компонента-растворителя.
3)Вычитание - фазы на основе химических соединений.
При полной взаимной растворимости компонентов в твердом состоянии микроструктура всех сплавов представляет собой зерна твердого раствора. При ограниченной растворимости, которая характерна для многих сплавов, структура состоит из смеси двух фаз.
18) Условия равновесия фаз. Виды фазовых превращений.
Условия равновесия фаз:
1) T1=T2=…
2) p1=p2=…
3) µ1=µ2=…(хим. потенциал по обе стороны границы раздела фаз)
Если все 3 уровня выполняются, то система нах-ся в равновесии.
Лабильное состояние – система абсолютно неустойчива
Классификация фазовых превращений:
I рода – скачкообразное изменение ТЛ потенциалов
 tф.п.
I
-> II
tф.п.
I
-> II
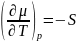 (энтропия)
(энтропия)
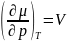 (объем)
(объем)
Этот переход сопровождается при t фазового перехода и скачком меняется потенциал системы.
К I роду относятся :
1) изменение агрегатного состояния
2) полиморфные (изменение крист. решетки)
3) процессы упорядочивания
II рода – непрерывное изменение ТД потенциалов.
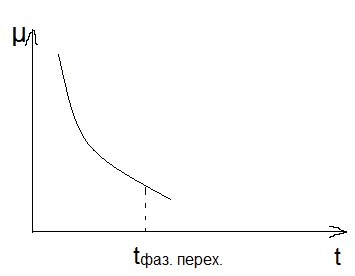
- процессы упорядочения
- магнитные процессы
20) Диаграмма сплавов, практически не растворяющихся друг в друге в твердом состоянии.
Диаграмма состояния - графическое изображение существования и сосуществования различных фаз в сплавах. Строят диаграмму состояния в координатах А и В. DEF – линия начала кристаллизации (линия ликвидус) MN – линия окончания кристаллизации – линия ликвидус. Е – точка эвтектики- дисперсная смесь 2 фаз одновременно кристаллизующихся из расплава при постоянной температура и состав ее уже определен. Левее точки Е доэвтектический, а после заэвтектический.

21) Диаграмма состояния сплавов, образующих неограниченные твердые растворы.


Металлы соединяясь в любых пропорциях, образуют непрерывный ряд твердых растворов, так как атомы одного способны заместить в кристаллической решетке все атомы другого. Чистые металлы (кривые 1 и 3) имеют одну критическую точку - температуру затвердевания (кристаллизации), а сплавы (кривые 2,) - две, т. е. сплавы в отличие от чистых металлов кристаллизуются в интервале температур. Например, кристаллизация сплава 2 начинается при температуре t1 , при этой температуре из жидкого сплава начинают выпадать первые кристаллы твердого α-раствора, а заканчивается кристаллизация при температуре t3 (точка b1). При этой температуре затвердевает последняя капля жидкого сплава. Разная температура конца кристаллизации сплавов свидетельствует о том, что состав твердой фазы непрерывно изменяется. Линия acb – линия начала кристаллизации (линия ликвидус) adb – линия окончания кристаллизации – линия ликвидус.
