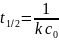- •Внутренняя энергия и энтальпия. 1 закон термодинамики. Термодинамические расчеты.
- •2) Энтропия, ее изменения при фазовых переходах и химических процессах. 2 и 3 законы термодинамики.
- •3) Энергия Гиббса. Термодинамическая оценка возможности реакций.
- •4) Понятия о химическом потенциале. Направление протекания процессов.
- •5) Химическое в гомогенных системах.
- •6) Константа равновесия. Зависимость константы равновесия от температуры.
- •7) Равновесие в гетерогенных системах.
- •8) Понятие скорости реакции.
- •9) Зависимость скорости реакции от концентрации реагентов. Закон действующих масс.
- •10) Температурная зависимость константы скорости.
- •11) Теория переходного состояния. Энергия активации. Суть теории переходного состояния (активированного комплекса):
- •13) Диффузия. Законы Фика.
- •12) Механизм и кинетика взаимодействия компонентов в гомогенных газообразных средах. Молекулярность и порядок реакций.
- •14) Особенности диффузионных процессов в твердых телах.
- •15) Влияние дефектов структуры на процесс диффузии. Кристаллизация сплавов. Процессы образования и роста зародышей новой фазы.
- •17) Правило фаз Гиббса.
- •19) Виды взаимодей-я компонентов в сплавах.
- •18) Условия равновесия фаз. Виды фазовых превращений.
- •21) Диаграмма состояния сплавов, образующих неограниченные твердые растворы.
- •23) Перитектическая кристаллизация, перитектоидное превращение.
- •22) Диаграмма состояния сплавов, образующих ограниченные твердые растворы.
- •27) Магнитное превращение.
- •24) Количественных расчет по диаграммам состояния. Правило отрезков.
- •25) Правило Курнакова. Связь между типом диаграммы состояния и свойствами сплавов.
- •26) Полиморфные превращения.
- •28) Особенности мартенситного превращения.
- •29) Распад пересыщенного твердого раствора. Процессы старения.
- •30) Спиноидальный распад.
- •31) Упорядочение атомов.
- •32) Понятие об адсорбции. Физическая адсорбция и хемосорбция.
- •34) Особенности адсорбции из растворов.
- •35) Поверхностно-активные вещества.
- •33) Изотермы адсорбции.
- •36) Явление смачивания.
- •37) Растворы. Парциальные мольные величины.
- •38) Совершенные растворы. Реальные растворы. Активность.
- •39) Равновесие в системе "жидкость - пар". Закон Рауля.
- •40) Закон распределения. Экстракция.
- •41) Теоретические основы процессов дистилляции, сублимации, ректификации металлов и их соединений.
- •42) Физико-химич. Основы зонной плавки.
- •43) Км. Общее понятие и классификация.
- •45) Межфазное взаимодействие в композиционных материалах. Выбор материала матриц и волокон.
13) Диффузия. Законы Фика.
Диффузия — процесс взаимного проникновения молекул одного вещества между молекулами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму.
Согласно первому закону Фика, диффузионный поток вещества через данное сечение в единицу времени прямо пропорционален градиенту концентраций dC/dx и площади сечения S:
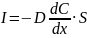
Изменение концентрации диффундирующего вещества со временем в некоторой области пространства описывается вторым законом Фика:
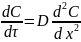
где dC/dx - градиент концентрации (определяется распределением концентрации (dC) по расстоянию (dx)); S - площадь сечения образца, на которой происходит диффузионный перенос вещества; d- время; D - коэффициент диффузии,
соответствующий количеству вещества, продиффундировавшего за 1 с через площадку 1 см2 при градиенте концентрации dС/dx, равном 1; размерность коэффициента диффузии см2/с.
12) Механизм и кинетика взаимодействия компонентов в гомогенных газообразных средах. Молекулярность и порядок реакций.
Под механизмом химической реакции понимают те промежуточные реакции, которые протекают при превращении исходных веществ в продукты реакции.
В зависимости от механизма все химические реакции классифицируют на простые (элементарные) и сложные. Простыми называются реакции, протекающие в одну стадию за счёт одновременного столкновения молекул, записанных в левой части уравнения. В простой реакции могут участвовать одна, две или, что встречается крайне редко, три молекулы. Поэтому простые реакции классифицируют на мономолекулярные, бимолекулярные и тримолекулярные реакции. Так как с точки зрения теории вероятности одновременное столкновение четырёх и более молекул маловероятно, реакции более высокой, чем три, молекулярности не встречаются.
Гомогенными химическими реакциями называются реакции, в которых реагирующие вещества находятся в одной фазе. Это могут быть реакции между газообразными веществами или реакции в водных растворах. Для таких реакций средняя скорость (равна изменению концентрации любого из реагирующих веществ в единицу времени)
Δc – единица концентрации Δτ – время
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко.
Если реакция протекает последовательно через несколько гомогенных или гетерогенных элементарных стадий, то суммарная скорость всего процесса определяется самой медленной его частью, а молекулярность заменяется порядком реакции – формальным показателем при концентрации реагирующих веществ. Поэтому весь процесс в целом лучше характеризует порядок реакции.
Порядок р-ции определяется опытным путем.
Для
1 порядка:
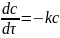
период
полупревращения:
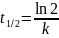
Для
2 порядка: