
- •Внутренняя энергия и энтальпия. 1 закон термодинамики. Термодинамические расчеты.
- •2) Энтропия, ее изменения при фазовых переходах и химических процессах. 2 и 3 законы термодинамики.
- •3) Энергия Гиббса. Термодинамическая оценка возможности реакций.
- •4) Понятия о химическом потенциале. Направление протекания процессов.
- •5) Химическое в гомогенных системах.
- •6) Константа равновесия. Зависимость константы равновесия от температуры.
- •7) Равновесие в гетерогенных системах.
- •8) Понятие скорости реакции.
- •9) Зависимость скорости реакции от концентрации реагентов. Закон действующих масс.
- •10) Температурная зависимость константы скорости.
- •11) Теория переходного состояния. Энергия активации. Суть теории переходного состояния (активированного комплекса):
- •13) Диффузия. Законы Фика.
- •12) Механизм и кинетика взаимодействия компонентов в гомогенных газообразных средах. Молекулярность и порядок реакций.
- •14) Особенности диффузионных процессов в твердых телах.
- •15) Влияние дефектов структуры на процесс диффузии. Кристаллизация сплавов. Процессы образования и роста зародышей новой фазы.
- •17) Правило фаз Гиббса.
- •19) Виды взаимодей-я компонентов в сплавах.
- •18) Условия равновесия фаз. Виды фазовых превращений.
- •21) Диаграмма состояния сплавов, образующих неограниченные твердые растворы.
- •23) Перитектическая кристаллизация, перитектоидное превращение.
- •22) Диаграмма состояния сплавов, образующих ограниченные твердые растворы.
- •27) Магнитное превращение.
- •24) Количественных расчет по диаграммам состояния. Правило отрезков.
- •25) Правило Курнакова. Связь между типом диаграммы состояния и свойствами сплавов.
- •26) Полиморфные превращения.
- •28) Особенности мартенситного превращения.
- •29) Распад пересыщенного твердого раствора. Процессы старения.
- •30) Спиноидальный распад.
- •31) Упорядочение атомов.
- •32) Понятие об адсорбции. Физическая адсорбция и хемосорбция.
- •34) Особенности адсорбции из растворов.
- •35) Поверхностно-активные вещества.
- •33) Изотермы адсорбции.
- •36) Явление смачивания.
- •37) Растворы. Парциальные мольные величины.
- •38) Совершенные растворы. Реальные растворы. Активность.
- •39) Равновесие в системе "жидкость - пар". Закон Рауля.
- •40) Закон распределения. Экстракция.
- •41) Теоретические основы процессов дистилляции, сублимации, ректификации металлов и их соединений.
- •42) Физико-химич. Основы зонной плавки.
- •43) Км. Общее понятие и классификация.
- •45) Межфазное взаимодействие в композиционных материалах. Выбор материала матриц и волокон.
33) Изотермы адсорбции.
Изотерма адсорбции — зависимость количества адсорбированного вещества от парциального давления этого вещества в газовой фазе (или концентрации раствора) при постоянной температуре.
Наиболее распространенными аналитическими выражениями изотерм адсорбции, являются уравнение Ленгмюра, в основу которой положены следующие постулаты:
1) Адсорбция является локализованной, т.е. молекулы адсорбтива не способны перемещаться на поверхности адсорбента.
2) Адсорбция молекул адсорбтива происходит на активных центрах.
3) Адсорбция является мономолекулярной.
4) Адсорбир-е молекулы удерживаются активными центрами только в течение определенного промежутка времени. Через опред-ый промежуток времени, в результате флюктуаций кинетической энергии, отрыв-ся молекулы от поверхности адсорбента и переходят в объем.
5) Отсутствуют силы взаимодействия между адсорбированными молекулами.
Исходя из этих положений, Ленгмюр дал общее уравнение изотерма адсорбции, пригодное для описания адсорбции как растворенных веществ, так и газов.
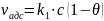
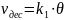
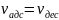
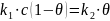
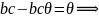
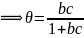
Графическое выражение этого уравнения приведено на рис. 1. На изотерме можно выделить три характерных участка. Начальный, круто поднимающийся почти прямолинейный участок указывает на то, что при малых концентрациях величина удельной адсорбционной способности прямо пропорциональна этим концентрациям. Это, в значительной степени, отвечает еще свободной поверхности адсорбента.
Рис. 1. Изотерма адсорбции Ленгмюра
36) Явление смачивания.
рис
θ – краевой угол смачивания
θ < 90° - жидкость смачивает тв. тело
Равновесие
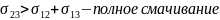
θ > 90° - жидкость не смачивает тв. тело
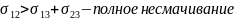
37) Растворы. Парциальные мольные величины.
Раствором называется однородная смесь, состоящая из двух или большего числа веществ, состав которой в известных пределах может непрерывно изменяться.
Однородными являются и химические соединения, однако их состав не может изменяться непрерывно, так как они подчиняются законам постоянства состава и кратных отношений.
Идеальные растворы
Цель термодинамической теории расплавов состоит в том, чтобы связать различные свойства растворов и найти способы предсказания свойств растворов, исходя из свойств чистых компонентов. Ввиду очень сложного характера взаимодействия компонентов в растворах решение этой задачи в общем виде невозможно. Поэтому целесообразно сначала рассмотреть идеализированные случаи, в которых можно отделить главные черты явления от второстепенных. [1]
Раствор называется идеальным, если : а) теплота смешения равна нулю б) изменение объема при смешении чистых компонентов равно нулю в) парциальное давление пара каждого компонента пропорционально его молярной доле. Это означает, при всех концентрациях соблюдается закон Рауля при условии, что пары следуют законам идеальных газов и, следовательно, парциальные давления равны летучим. [7]
Идеальным называется раствор, в котором соблюдается закон Рауля при температурах и давлениях, при которых возможно его существование. Закон Рауля гласит, что для ограниченного числа растворов парциальное давление каждого компонента pi равно произведению молярной доли компонента xi на упругость пара в его чистом виде :
Теплота образования идеального раствора. Поскольку, суммарная энергия взаимодействия частиц при образовании идеального раствора из чистых компонентов не изменяется (такие растворы называют совершенными), парциальные объемы компонентов и их парциальные энтальпии будут равны соответствующим мольным характеристикам: [pic]. [6] Таким образом, теплота испарения компонента в идеальном растворе равна теплоте испарения его в чистом виде. [2] В этом случае энтальпия раствора аддитивно складываются из мольных величин
Для установления зависимости равновесных свойств растворов от состава и свойств компонентов его составляющих пользуются парциальными молярными величинами, которые по своему смыслу отличаются от тех или иных парциальных величин
