
- •Внутренняя энергия и энтальпия. 1 закон термодинамики. Термодинамические расчеты.
- •2) Энтропия, ее изменения при фазовых переходах и химических процессах. 2 и 3 законы термодинамики.
- •3) Энергия Гиббса. Термодинамическая оценка возможности реакций.
- •4) Понятия о химическом потенциале. Направление протекания процессов.
- •5) Химическое в гомогенных системах.
- •6) Константа равновесия. Зависимость константы равновесия от температуры.
- •7) Равновесие в гетерогенных системах.
- •8) Понятие скорости реакции.
- •9) Зависимость скорости реакции от концентрации реагентов. Закон действующих масс.
- •10) Температурная зависимость константы скорости.
- •11) Теория переходного состояния. Энергия активации. Суть теории переходного состояния (активированного комплекса):
- •13) Диффузия. Законы Фика.
- •12) Механизм и кинетика взаимодействия компонентов в гомогенных газообразных средах. Молекулярность и порядок реакций.
- •14) Особенности диффузионных процессов в твердых телах.
- •15) Влияние дефектов структуры на процесс диффузии. Кристаллизация сплавов. Процессы образования и роста зародышей новой фазы.
- •17) Правило фаз Гиббса.
- •19) Виды взаимодей-я компонентов в сплавах.
- •18) Условия равновесия фаз. Виды фазовых превращений.
- •21) Диаграмма состояния сплавов, образующих неограниченные твердые растворы.
- •23) Перитектическая кристаллизация, перитектоидное превращение.
- •22) Диаграмма состояния сплавов, образующих ограниченные твердые растворы.
- •27) Магнитное превращение.
- •24) Количественных расчет по диаграммам состояния. Правило отрезков.
- •25) Правило Курнакова. Связь между типом диаграммы состояния и свойствами сплавов.
- •26) Полиморфные превращения.
- •28) Особенности мартенситного превращения.
- •29) Распад пересыщенного твердого раствора. Процессы старения.
- •30) Спиноидальный распад.
- •31) Упорядочение атомов.
- •32) Понятие об адсорбции. Физическая адсорбция и хемосорбция.
- •34) Особенности адсорбции из растворов.
- •35) Поверхностно-активные вещества.
- •33) Изотермы адсорбции.
- •36) Явление смачивания.
- •37) Растворы. Парциальные мольные величины.
- •38) Совершенные растворы. Реальные растворы. Активность.
- •39) Равновесие в системе "жидкость - пар". Закон Рауля.
- •40) Закон распределения. Экстракция.
- •41) Теоретические основы процессов дистилляции, сублимации, ректификации металлов и их соединений.
- •42) Физико-химич. Основы зонной плавки.
- •43) Км. Общее понятие и классификация.
- •45) Межфазное взаимодействие в композиционных материалах. Выбор материала матриц и волокон.
Внутренняя энергия и энтальпия. 1 закон термодинамики. Термодинамические расчеты.
Энергия изолир. системы const. Она может изменяться за счет: 1) соверш-я работы А над окр. средой.
2) обмена теплотой Q с окр средой.
dU = δQ + δА(диф. форма)
ΔU = Q + А (инт. форма)
В отличие от внутр. энергии понятие теплоты и работы отн-ся не к системе, а к процессам. Работа – упорядоч-я форма передачи энергии, а теплота – неупоряд-я, связанная с хаотич. движением частиц.
2) Энтропия, ее изменения при фазовых переходах и химических процессах. 2 и 3 законы термодинамики.
Направл. протекания процесса опред-ся 2-мя тенденциями: 1) стремление системы к переходу в сост. с наим. внутр. энергием (энтальпийный)
2) стрем-и системы к переходу в более вероятное состояние (энтропийный)
Энтропия – мера беспорядка системы

2 з-н ТД: В изол. системе dS >= 0 процесс протекает самопроизвольно в сторону ↑ энтропии. dS = 0 – условие равновесия
3 з-н ТД: S простых вещ-в → 0 при Т→ 0
3) Энергия Гиббса. Термодинамическая оценка возможности реакций.
Энергия Гиббса – это вел-на, показывающая изменение энергии в ходе хим. реакции и дающая т. о. ответ на вопрос о возможности протекания хим. р-ции. Опред-ся формулой
ΔG = ΔH – TΔS
При ΔG < 0 – реакция возможна
ΔG > 0 – реакция невозможна
ΔG = 0 – реакция равновесия
4) Понятия о химическом потенциале. Направление протекания процессов.
Хим. потен-л равен изменению энергии Гиббса при добавлении 1 моль данного компонента при p=const, T=const
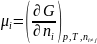
n – кол-во моль каждого из компонентов
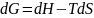
Для идеального газа:
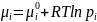
Направление протекания процессов определяется принципом Ле-Шателье: всякое внешнее воздействие на систему, находящуюся в равновесии смещает равновесие в сторону умень-я этого воздействия (потому что это выгодно системе):
Факторы: 1) при ↑ Т равновесие смещается в сторону эндотермической (нужен подвод тепла)
2) при ↑ конц-ции к.-л. реагентов – в сторону расхода этого реагента, при ↓ - в сторону образования
3) при ↑ р – в сторону реакции, идущей с ↓ V газа.
5) Химическое в гомогенных системах.
При равенстве энтальпийного и энтроп-го факторов ΔН = ТΔS ΔG = 0, что является термодинамическим условием химического равновесия. Химическое равновесие имеет динамический характер. Скорость реакции в прямом направлении равна скорости реакции в обратном направлении. В этот момент концентрации исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями.
При равновесии химической реакции:
aA + bB = cC + dD
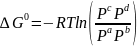 ,
,
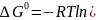 ,
,
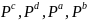 -
парциальные
давления веществ, а [А],[В],[C],[D]
–равновесные концентрации
веществ; a, b, c, d -
показатели степени, равные стехиометрическим
коэффициентам.
-
парциальные
давления веществ, а [А],[В],[C],[D]
–равновесные концентрации
веществ; a, b, c, d -
показатели степени, равные стехиометрическим
коэффициентам.
Отношения произведений парциальных давлений или концентраций получили названия констант химического равновесия соответственно Кр или Кс:
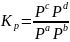 ΔG0 = ΔH – TΔS.
ΔG0 = ΔH – TΔS.
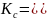 lnКс =
- ΔG0/RT.
lnКс =
- ΔG0/RT.
Эти уравнения являются математическими выражениями закона действующих масс:
отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, при Т = соnst, является величиной постоянной.
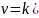
Это изобара равновесия. Она показывает, что константа равновесия экзотермической реакции уменьшается, а эндотермической реакции возрастает с повышением температуры. С увеличением абсолютного значения энтальпии реакции и уменьшением температуры чувствительность константы равновесия к изменению температуры повышается.
При изменении равновесных концентраций исходных веществ и продуктов реакции путем воздействия на систему происходит смещение химического равновесия. Если увеличиваются равновесные концентрации продуктов реакции, то говорят о смещении равновесия вправо. Если при внешнем воздействии увеличиваются концентрации исходных веществ, то говорят о смещении равновесия влево.
Характер смещения равновесия можно прогнозировать, применяя принцип Ле Шателье:
если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет внешнее воздействие.
Принцип Ле Шателье следует из закона действующих масс. Если система находится при постоянной температуре, то константа равновесия при внешних воздействиях остается постоянной. Поэтому любое изменение равновесных концентраций веществ должно приводить к такому изменению равновесных концентраций других веществ, чтобы соблюдалось постоянство константы равновесия.
