
- •1. Органическая химия: определение, задачи
- •2. Классификация органических сединений
- •3. Теория строения Бутлерова
- •4. Взаимное влияние атомов в молекуле и её природа
- •5. Эффекты сопряжения и сверхсопряжения
- •6. Предельные углеводороды
- •7. Химические свойства предельных углеводородов
- •1.Радикальное галогенирование
- •2. Нитрование
- •3.Сульфирование, сульфоокисление, сульфохлорирование
- •4.Окисление
- •5.Крекинг углеводородов при высоких температурах
- •8. Этиленовые углеводороды
- •9. Общая характеристика алкенов
- •10. Ацетиленовые углеводороды
- •11. Химические свойства ацетиленовых углеводородов
- •2.Галогенирование
- •3.Гидрогалогенирование
- •9. Полимеризация
- •12.Типы диеновых углеводородов
- •1.Гидрирование
- •2.Галогенирование
- •13. Алициклические углеводороды
- •14. Современные представления об устойчивости циклов
- •15. Ароматические углеводороды
- •16. Строение бензола
- •17. Химические свойства ароматических углеводородов
- •1.Реакции присоединения
- •2.Реакции окисления
- •3.Реакции замещения
- •18. Механизм электрофильного замещения в ряду бензола
- •19. Правила ориентации в ряду бензола
- •20. Галогенопроизводные углеводородов
- •21. Химические свойства галогенопроизводных
- •2.Реакции замещения
- •3.Реакции по бензольному кольцу
- •22. Нитросоединения
- •23. Амины
- •24. Спирты и фенолы
- •25. Карбонильные соединения
- •26. Общие и отличительные свойства альдегидов и кетонов
- •27. Карбоновые кислоты
- •28. Химические свойства карбоновых кислот
- •29. Гетероциклические соединения
- •30. Липиды
- •31. Простые липиды
- •32. Углеводы
- •33. Моносахариды
- •34. Дисахариды
- •35. Высокомолекулярные полисахариды
- •36.Аминокислоты
- •37. Пептиды
- •38. Белки
- •39. Способы получения оксикислот
- •40. Способы получения оксокислот
- •Способы получения
- •Химические особенности
7. Химические свойства предельных углеводородов
Химические превращения предельных углеводородов могут происходить либо за счет разрыва цепи углеродных атомов, либо за счет отрыва атомов водорода с последующим замещением их другими атомами или группами. Поэтому для предельных углеводородов характерны реакции расщепления и замещения.
Процессы расщепления связей С-С или С-Н с образованием свободных радикалов требуют большой энергии активации и поэтому при обычной температуре идут только в присутствии катализаторов.
Место вступления заместителя в молекулу алкана определяется в первую очередь вероятностью образования того или иного радикала, т.е. прочностью связей водородного атома с углеродом и стабильностью возникающего радикала.
1.Радикальное галогенирование
Замещение водородных атомов на галоген – одна из наиболее характерных реакций предельных углеводородов. С F2 реакция идет со взрывом, а с J2 – процесс ограничен равновесием, т.к. йодистый водород восстанавливает образующиеся йодистые алкилы. Следовательно, скорость галогенирования с одной стороны зависит от природы галогена (F>>Cl>Br>J), а с другой от строения углеводорода. Общеизвестно, что легче всего галогенирование протекает по третичному углеродному атому, а труднее всего – по первичному.
Галогеном можно заместить как один атом водорода в молекуле, так и все.
![]()
хлористый метил
![]()
хлористый метилен
![]()
Хлороформ
![]()
четыреххлористый углерод
Галогенирование алканов на свету или под действием высоких температур протекает по цепному радикальному механизму и является типичным примером радикального замещения (SR).
СН4 + Br2 → СН3Br + НBr
На первой стадии под влиянием света происходит гомолитический разрыв связи в молекуле брома и она распадается на два радикала:
Br2
![]() 2 Br*
2 Br*
Атом или молекула подобного типа, содержащие неспаренный электрон, называются свободными радикалами и, как правило, существуют лишь доли секунды, так как мгновенно реагируют с присутствующими веществами.
Поэтому на следующей стадии реакции радикал Br• атакует молекулу метана, образуя бромистый водород и углеводородный радикал – метил:
СН4 + Br* → НBr + СН3*
Образовавшийся органический радикал атакует молекулу брома и регенерирует радикал галогена:
СН3* + Br2 → СН3Br + Br*
Этот процесс может продолжаться бесконечно долго, но на практике течение цепных реакций ограничивается так называемыми процессами обрыва цепи, при которых радикалы, реагируя один с другим, выбывают из процесса:
Br• + Br• → Br2
CH3• + Br• → CH3Br
CH3• + CH3• → CH3-CH3
Кроме того, они могут взаимодействовать с примесями или со стенками сосуда.
2. Нитрование
Концентрированная азотная кислота при обычной температуре почти не действует на предельные углеводороды, а при нагревании действует как окислитель. М. И. Коновалов предложил проводить нитрование предельных углеводородов разбавленной азотной кислотой при нагревании (около 140 оС). По механизму реакция нитрования является свободно радикальным процессом:
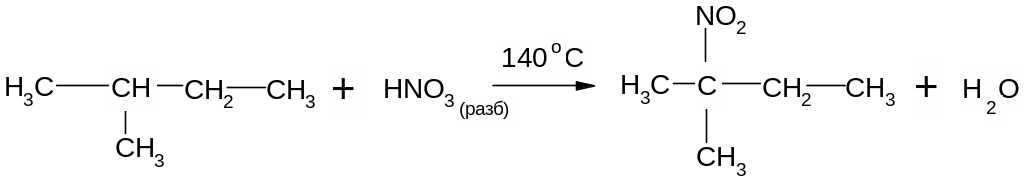
2-метил-2-нитробутан
В случае разветвленной молекулы алкана легче всего замещается водород у третичного углеродного атома. В промышленных условиях нитрование осуществляют оксидами азота.
