
- •1. Органическая химия: определение, задачи
- •2. Классификация органических сединений
- •3. Теория строения Бутлерова
- •4. Взаимное влияние атомов в молекуле и её природа
- •5. Эффекты сопряжения и сверхсопряжения
- •6. Предельные углеводороды
- •7. Химические свойства предельных углеводородов
- •1.Радикальное галогенирование
- •2. Нитрование
- •3.Сульфирование, сульфоокисление, сульфохлорирование
- •4.Окисление
- •5.Крекинг углеводородов при высоких температурах
- •8. Этиленовые углеводороды
- •9. Общая характеристика алкенов
- •10. Ацетиленовые углеводороды
- •11. Химические свойства ацетиленовых углеводородов
- •2.Галогенирование
- •3.Гидрогалогенирование
- •9. Полимеризация
- •12.Типы диеновых углеводородов
- •1.Гидрирование
- •2.Галогенирование
- •13. Алициклические углеводороды
- •14. Современные представления об устойчивости циклов
- •15. Ароматические углеводороды
- •16. Строение бензола
- •17. Химические свойства ароматических углеводородов
- •1.Реакции присоединения
- •2.Реакции окисления
- •3.Реакции замещения
- •18. Механизм электрофильного замещения в ряду бензола
- •19. Правила ориентации в ряду бензола
- •20. Галогенопроизводные углеводородов
- •21. Химические свойства галогенопроизводных
- •2.Реакции замещения
- •3.Реакции по бензольному кольцу
- •22. Нитросоединения
- •23. Амины
- •24. Спирты и фенолы
- •25. Карбонильные соединения
- •26. Общие и отличительные свойства альдегидов и кетонов
- •27. Карбоновые кислоты
- •28. Химические свойства карбоновых кислот
- •29. Гетероциклические соединения
- •30. Липиды
- •31. Простые липиды
- •32. Углеводы
- •33. Моносахариды
- •34. Дисахариды
- •35. Высокомолекулярные полисахариды
- •36.Аминокислоты
- •37. Пептиды
- •38. Белки
- •39. Способы получения оксикислот
- •40. Способы получения оксокислот
- •Способы получения
- •Химические особенности
3. Теория строения Бутлерова
Начиная с 1858 (1861) года А.М. Бутлеров развивает и экспериментально обосновывает теорию химического строения, основываясь на атомистическом учении М. В. Ломоносова и Дальтона. Эта теория остается основополагающей до настоящего времени. Основные идеи теории могут быть кратко изложены следующим образом:
1. В молекулах соединений существует определенный порядок связи атомов, который и носит название строение.
2. Химические свойства соединения определяются свойствами и строением его молекулы.
3. Различное строение при одном и том же свойстве и молекулярной массе вещества обуславливает явление изомерии.
4. Так как при отдельных реакциях изменяются не все, а только некоторые части молекул, то изучая продукты химических превращений соединения, можно установить его строение.
5. Химический характер (т.е. реакционная способность) атомов, входящих в молекулу меняется в зависимости от того, с какими атомами они связаны в данной молекуле. Это изменение химического характера обуславливается главным образом взаимным влиянием непосредственно связанных друг с другом атомов. Взаимное влияние атомов, не связанных непосредственно, обычно проявляется значительно слабее.
4. Взаимное влияние атомов в молекуле и её природа
Взаимное влияние непосредственно связанных между собой атомов зависит в первую очередь от их природы и характера связи между ними.
Различают два основных типа химической связи: ковалентную и электровалентную (ионную).
Электровалентная (ионная) связь образуется между атомами значительно отличающимися по электроотрицательности:
Nao + Clo → Na+Cl–
Эта связь не характерна для органических соединений.
Ковалентная связь возникает в результате обобщения неспаренных валентных электронов. Атомы с одинаковой или близкой по значению электроотрицательностью находясь на достаточно близком расстоянии перекрываются атомными орбиталями с образованием единой связывающей молекулярной орбитали на которой и располагаются оба электрона:
Н![]() + Н
→ Н
+ Н
→ Н![]() Н
Н
Разновидностью ковалентной связи является координационная (донорно-акцепторная) связь. При ее возникновении пару электронов, связывающих два ядра, представляет только один из атомов (донор), тогда как другой атом представляет только свою незаполненную орбиталь (акцептор)
![]()
В органической химии очень часто встречается водородная связь. Если атом водорода связан с сильно электроотрицательными элементами (О, N, F), то в результате существенного смещения электронной плотности к электроотрицательному элементу первый приобретает частичный положительный заряд и может электростатически взаимодействовать с обогащенным электронной плотностью центром:
–О←Н∙∙∙О–
Важным критерием отличия ковалентной связи от ионной является полярность, т.е. наличие постоянного дипольного момента. Для ковалентной связи дипольный момент мал 0,4 ÷ 1,5D.
Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
Электронная конфигурация основного состояния атома углерода 1s22s22p2, т.е. углерод должен проявлять валентность, равную двум, так как на внешнем электронном уровне находится два неспаренных (валентных) электрона. Как известно, в большинстве органических соединений углерод четырехвалентен, поскольку в процессе образования связей атом углерода переходит в возбужденное состояние. В возбужденном состоянии валентные электроны не равноценны. Согласно экспериментальным данным в молекуле метана все четыре связи атома углерода с атомами водорода одинаковы. Противоречие между теорией и экспериментом было разрешено введением понятия гибридизация орбиталей.
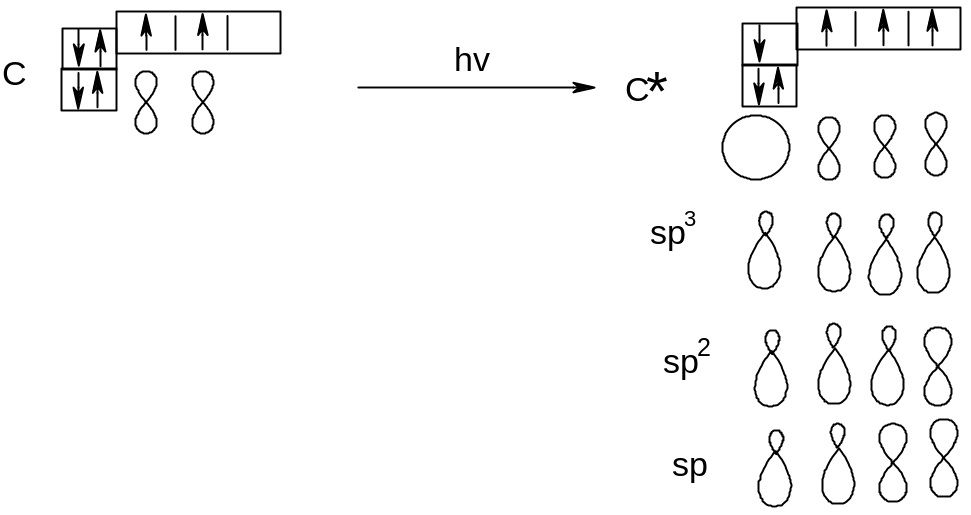
Для атома углерода характерно три валентных состояния, т.е. три типа гибридизации.
В зависимости от типа гибридизации между атомами углерода могут образовываться два типа ковалентной связи: σ- и π.
σ-Связь образуется при перекрывании валентных орбиталей по прямой, соединяющей центры реагирующих атомов. В зависимости от природы атомов образующих эту связь она может быть полярной и неполярной. Полярность ковалентной σ-связи показывается стрелкой по связи в структурной формуле.
π-Связь образуется за счет двойного перекрывания р-электронных орбиталей, располагающихся на параллельных осях. π-связь в отличие от σ-связи способна поляризоваться, т.е. изменять распределение электронной плотности в момент реакции.
Способность органической молекулы к тем или иным типам превращений определяется энергией связи, длиной связи, а также распределением и подвижностью электронной плотности. Распределение и подвижность электронной плотности зависит от полярности и поляризуемости связи, которые в сложных молекулах проявляются в виде эффектов: индукционного, сопряжения, сверхсопряжения.
Полярность связи определяется электроотрицательностью атомов, образующих связь, т.е. способностью атомов в молекуле притягивать к себе электронную плотность. Поляризация одной какой-либо связи в сложной молекуле оказывает влияние на состояние соседних связей. Дипольный момент индуцирует в них также дипольные моменты, значительно меньшие по величине. Такой эффект называется индукционным:
![]()
Индукционный эффект сказывается на реакционной способности молекулы, но затухает по углеродной цепи к 4 – 5 углеродному атому
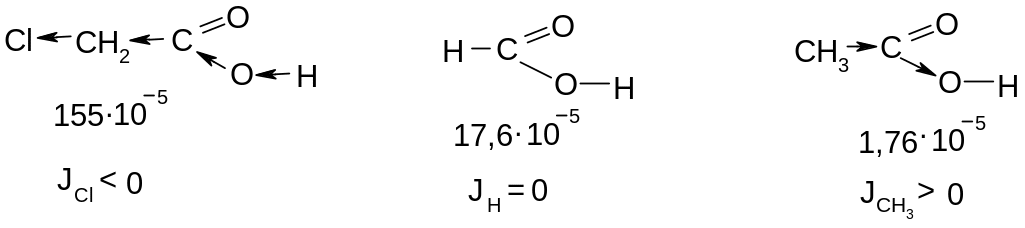
Способность ковалентных связей к перераспределению электронной плотности в момент реакции под влиянием различных факторов, называется поляризуемостью.
