
- •1. Органическая химия: определение, задачи
- •2. Классификация органических сединений
- •3. Теория строения Бутлерова
- •4. Взаимное влияние атомов в молекуле и её природа
- •5. Эффекты сопряжения и сверхсопряжения
- •6. Предельные углеводороды
- •7. Химические свойства предельных углеводородов
- •1.Радикальное галогенирование
- •2. Нитрование
- •3.Сульфирование, сульфоокисление, сульфохлорирование
- •4.Окисление
- •5.Крекинг углеводородов при высоких температурах
- •8. Этиленовые углеводороды
- •9. Общая характеристика алкенов
- •10. Ацетиленовые углеводороды
- •11. Химические свойства ацетиленовых углеводородов
- •2.Галогенирование
- •3.Гидрогалогенирование
- •9. Полимеризация
- •12.Типы диеновых углеводородов
- •1.Гидрирование
- •2.Галогенирование
- •13. Алициклические углеводороды
- •14. Современные представления об устойчивости циклов
- •15. Ароматические углеводороды
- •16. Строение бензола
- •17. Химические свойства ароматических углеводородов
- •1.Реакции присоединения
- •2.Реакции окисления
- •3.Реакции замещения
- •18. Механизм электрофильного замещения в ряду бензола
- •19. Правила ориентации в ряду бензола
- •20. Галогенопроизводные углеводородов
- •21. Химические свойства галогенопроизводных
- •2.Реакции замещения
- •3.Реакции по бензольному кольцу
- •22. Нитросоединения
- •23. Амины
- •24. Спирты и фенолы
- •25. Карбонильные соединения
- •26. Общие и отличительные свойства альдегидов и кетонов
- •27. Карбоновые кислоты
- •28. Химические свойства карбоновых кислот
- •29. Гетероциклические соединения
- •30. Липиды
- •31. Простые липиды
- •32. Углеводы
- •33. Моносахариды
- •34. Дисахариды
- •35. Высокомолекулярные полисахариды
- •36.Аминокислоты
- •37. Пептиды
- •38. Белки
- •39. Способы получения оксикислот
- •40. Способы получения оксокислот
- •Способы получения
- •Химические особенности
25. Карбонильные соединения
К классу оксосоединений относятся органические вещества, содержащие карбонильную группу >С=О. В молекулах альдегидов по крайней мере одна валентность карбонильных групп затрачивается на соединение с атомом водорода, а другая с радикалом:
![]()
В случае кетонов обе валентности карбонильной группы затрачиваются на соединение с радикалами
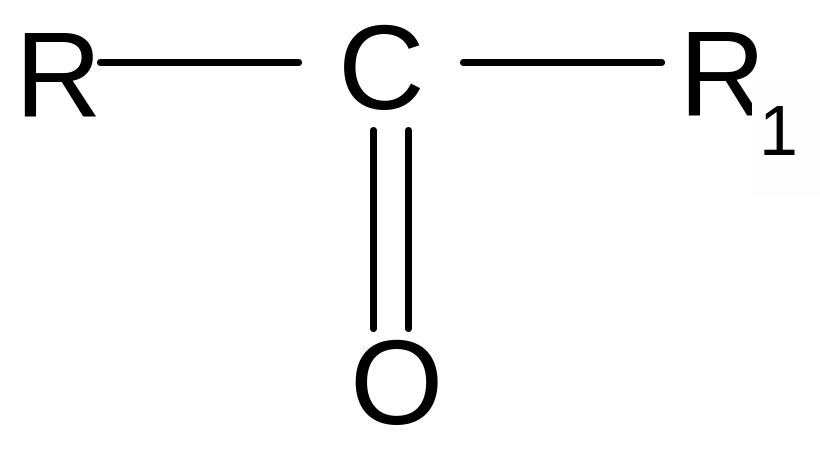
С карбонильной группой могут быть связаны предельные и ненасыщенные алифатические, ароматические и карбоциклические радикалы.
Реакции нуклеофильного присоединения к карбонильной группе начинаются с взаимодействия положительно заряженного карбонильного углерода со свободной электронной парой нуклеофильного реагента. На этом этапе реакция протекает медленно
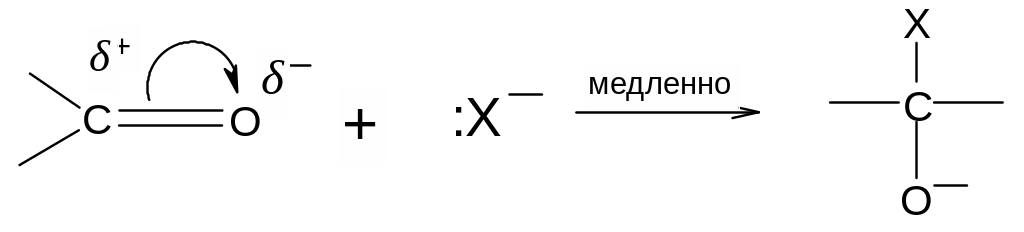
Вторая стадия – присоединение протона (или другого катиона) к образовавшемуся аниону протекает быстро:
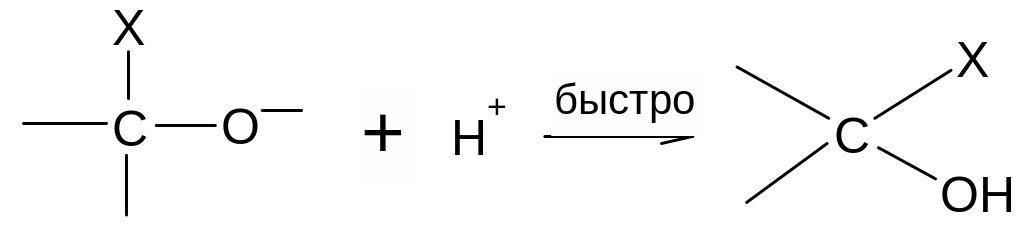
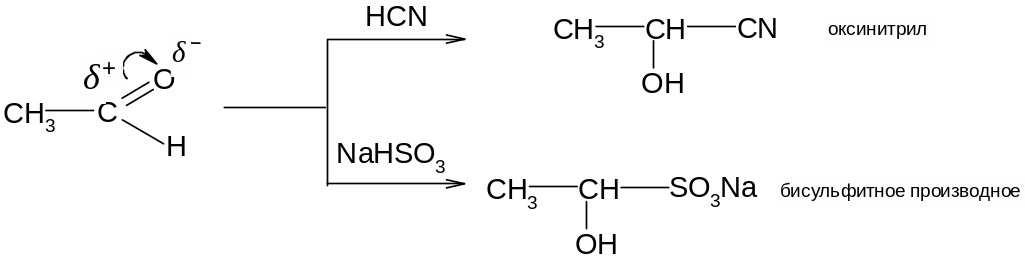
1. По этому механизму к карбонильным соединениям присоединяются синильная кислота, гидросульфит натрия, магнийорганические соединения, водород:
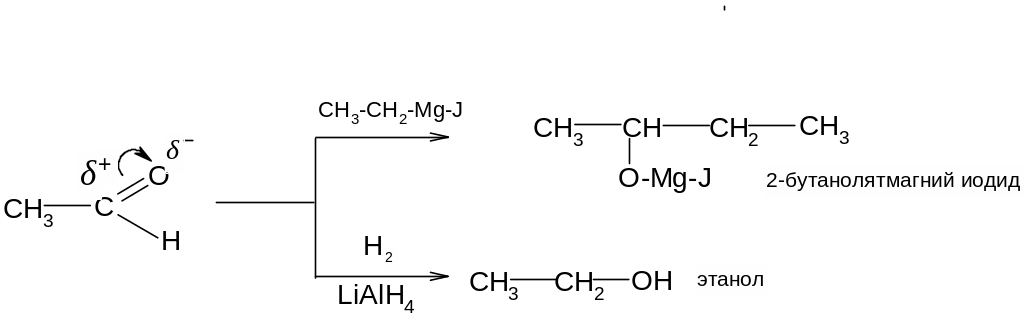
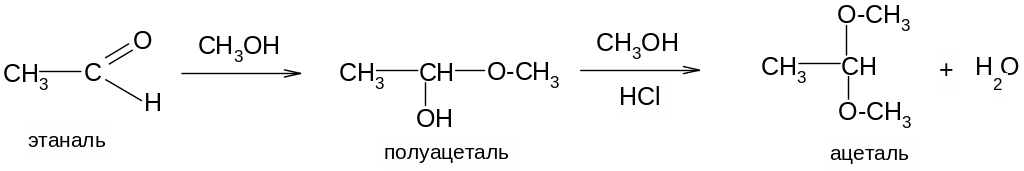
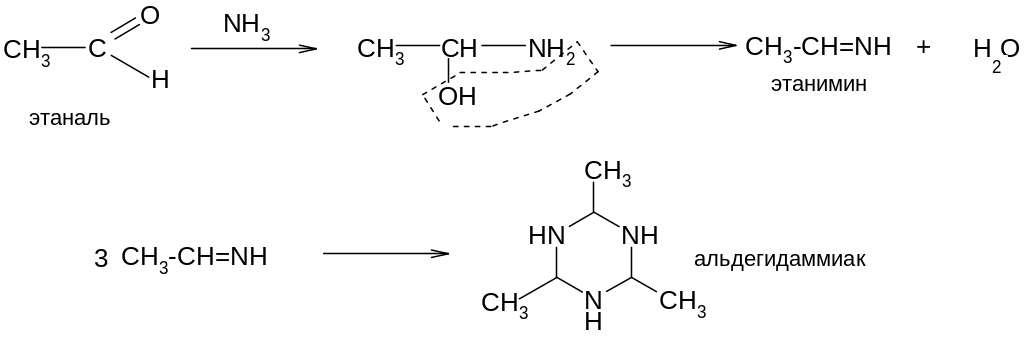
2. Альдегиды, но не кетоны по данному механизму реагируют со спиртами, образуя полуацетали и ацетали, а также с аммиаком, альдимины и альдегидаммиаки:
26. Общие и отличительные свойства альдегидов и кетонов
Как альдегиды, так и кетоны могут присоединять водород, синильную кислоту, магнийорганические соединения, гидросульфит натрия. Из кетонов с гидросульфитом натрия реагируют только те, которые содержат метильную или две метиленовые группы в непосредственном соседстве с карбонилом. С гидроксиламином, гидразином и его производными альдегиды и кетоны реагируют с образованием оксимов, гидразонов, фенилгидразонов и т. д. При действии галогенидов фосфора и серы атом кислорода в молекулах альдегидов и кетонов замещается двумя атомами галогена.
Однако между альдегидами и кетонами имеются существенные различия. Так, в отличие от альдегидов кетоны не окрашивают бесцветный раствор фуксинсернистой кислоты, в мягких условиях не конденсируются под действием щелочей, не дают со спиртами ацеталей, не дают реакции серебряного зеркала.
Окисляются кетоны труднее, чем альдегиды, причем при их окислении происходит разрыв углерод–углеродной связи; труднее для кетонов протекают и реакции конденсации; кетоны дают цветную реакцию с нитропруссидом натрия.
27. Карбоновые кислоты
Органические карбоновые кислоты характеризуются наличием карбоксильной групп ─СООН. По числу этих групп различают одно–, двух– и вообще многоосновные кислоты. Органические кислоты могут быть алифатическими (предельными и непредельными), алициклическими, ароматическими.
Номенклатура и изомерия
Изомерия карбоновых кислот определяется строением радикала, связанного с карбоксильной группой.
По номенклатуре ИЮПАК кислоты называют по соответствующим углеводородам с добавлением окончания –овая и слова кислота, причем нумерация цепи начинается с углерода карбоксильной группы. Однако, в большинстве случаев, используют тривиальные названия.

Иногда при составлении рациональных названий кислот с разветвленной цепью атомов углерода их рассматривают как производные уксусной кислоты, в молекуле которой атомы водорода метильной группы замещены радикалами, например:

Способы получения
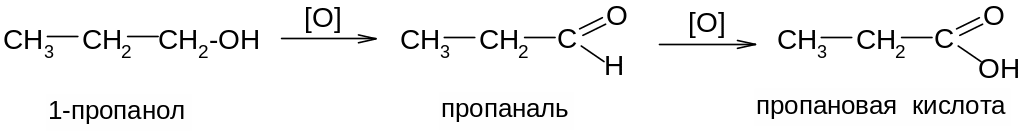
1. Окисление органических соединений (углеводородов, спиртов, альдегидов, кетонов):
2. Гидролиз нитрилов

3. Действие двуокиси углерода на металлорганические соединения:
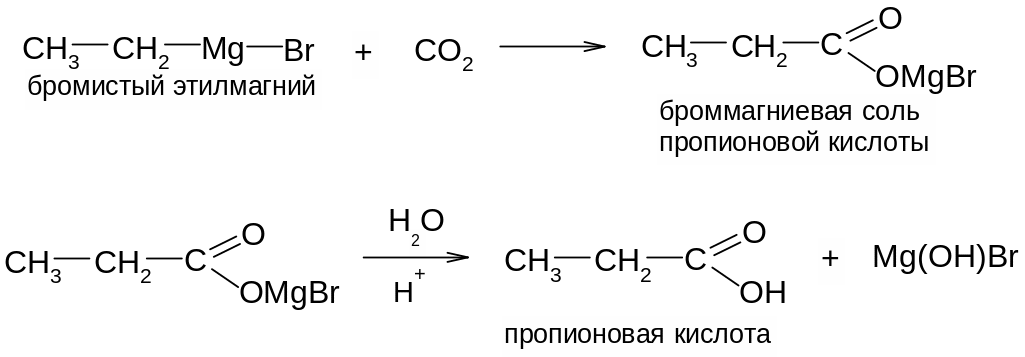
4. Оксосинтез. Взаимодействие олефинов с оксидом углерода (II) и водяным паром в присутствии катализаторов (тетракарбонил никеля, фосфорной кислоты и др.) при температуре 300–4000С и давлении 2–5∙107 Па дает смесь кислот нормального и изостроения:
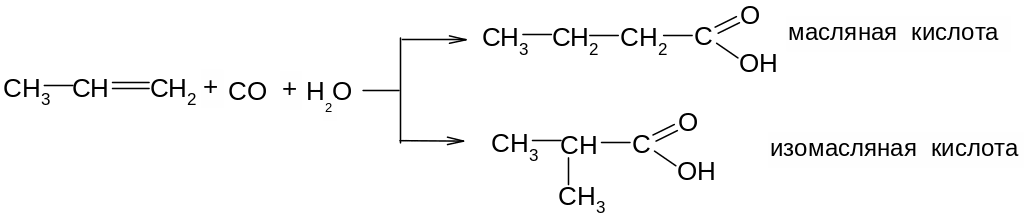 5.
Гидролиз тригалогенопроизводных,
содержащих галоген у одного углеродного
атома:
5.
Гидролиз тригалогенопроизводных,
содержащих галоген у одного углеродного
атома:
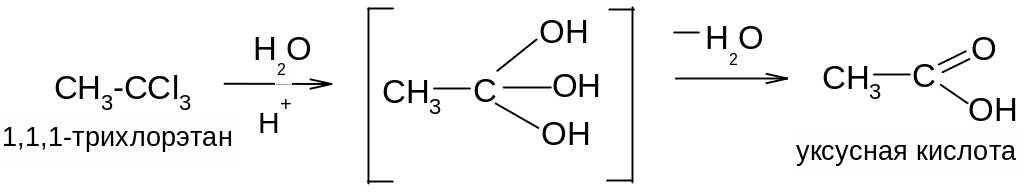
6. Ароматические кислоты могут быть получены окислением гомологов бензола:
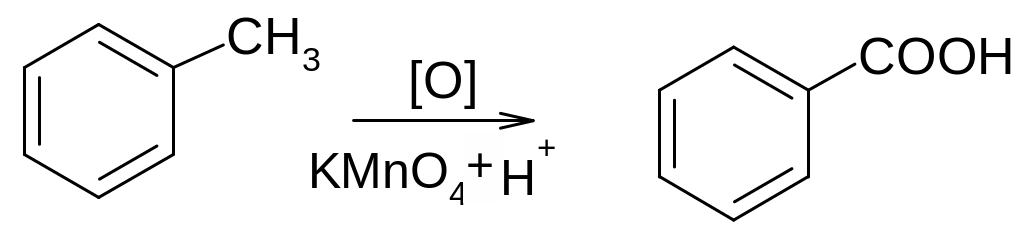
7. Кроме того, ароматические карбоновые кислоты могут быть получены:
а) сплавлением ароматических сульфатов с формиатами и цианидами

б) реакцией ароматических соединений с галогенопроизводными угольной кислоты:

