
- •1.Идеальный газ, определение и свойства.
- •2.Термодинамическая система, термодин. Процесс, параметры идеал. Газа.
- •3.Уравнение состояния идеального газа. Физический смысл газовой постоянной.
- •4.Внутренняя энергия идеального газа. Параметр состояния.
- •5.Работа газа . Параметр процесса.
- •6.Теплоёмкость газа.
- •7. Газовые смеси.
- •9. Выражение 1-ого закона термодинамики для различных процессов.
- •10.Круговые циклы. Термодин. И холодильный коэф.
- •11. Цикл Карно. Теорема Карно.
- •12. Реальный газ. Парообразование в координатах pv. Теплота парообразования. Степень сухости пара.
- •13. Влажный воздух. Его св-ва.
- •15. Темпер. Поле тела. Темпер. Градиент.
- •16.Теплопроводность. Закон Фурье.
- •17. Теплопроводность плоской стенки. Осн. Ур-ние теплопроводности.
- •19. Опред. Коэф. Теплоотдачи с использ. Критериальных ур-ний.
- •20.Лучистый теплообмен. Ур-ние Стефана-Больцмана.
- •21. Закон Кирхгофа, Ламберта.
- •22. Теплоотдача. Определение процесса. Ур-ние и коэф. Теплоотдачи для плоской стенки.
- •23. Теплообменные аппараты. Опред. Поверх. Нагрева.
- •24. Микроклимат помещений.
- •25.Сопротивление теплопередачи.
- •26. Теплоустойчивость ограждений. Коэффициент теплоусвоения s. Величина тепловой инерции d.
- •27. Воздухопроницаемость ограждений. Сопротивление воздухопроницаемости ограждений.
- •28.Определение тепловых потерь через ограждения
- •29. Определение тепловых потерь здания по укрупненным измерителям.
- •30. Системы отопления: осн. Элем., классификация, требования к отопит. Установке.
- •31. Система водяного отопления с естественной и искусств. Циркуляцией. Основные схемы.
- •34.Трубопроводы систем ценнтрального отопления, их соединения.
- •35.Расширительный бак.
- •36.Воздухоудаление.
- •37. Системы парового отопления. Принцип работы, классификация, основные схемы. Воздухоудаление из систем парового отопления. Область применения систем газового отопления.
- •38.Нагревательные приборы систем центр. Отопления.
- •39.Размещение отопительныхых приборов.
- •40. Выбор типа нагревательных приборов и определение их поверхности нагрева.
- •41. Особенности расчета поверхности нагревательных приборов для однотрубной системы отопления.
- •42.Регулировка теплоотдачи нагр. Приборов.
- •43. Топливо.
- •44. Горение топлива. Теоретический и действительный объем воздуха, необходимый для горения воздуха.
- •47. Централизованное теплоснабжение. Схема тэц.
- •48.Присоединение местных сист. Отопления к тепл. Сетям
- •49.Назначение и классификация систем вентиляции, воздухообмен, способы его определения.
- •50. Естественная вентиляция: инфильтрация, аэрация, канальная система венциляции.
- •51.Аэродинамический расчет естественной вытяжной системы вентиляции.
- •52. Механические системы вентиляции.
- •53.Устройства для очистки воздуха.
- •54. Устройства для подогрева воздуха.
- •55. Вентиляторы: классификация, принцип действия осевых и центробежных вентиляторов. Подбор вентиляторов.
5.Работа газа . Параметр процесса.
Для определения работы рабочего тела удобно воспользоваться графическим изображением процессов в координатах p-v.
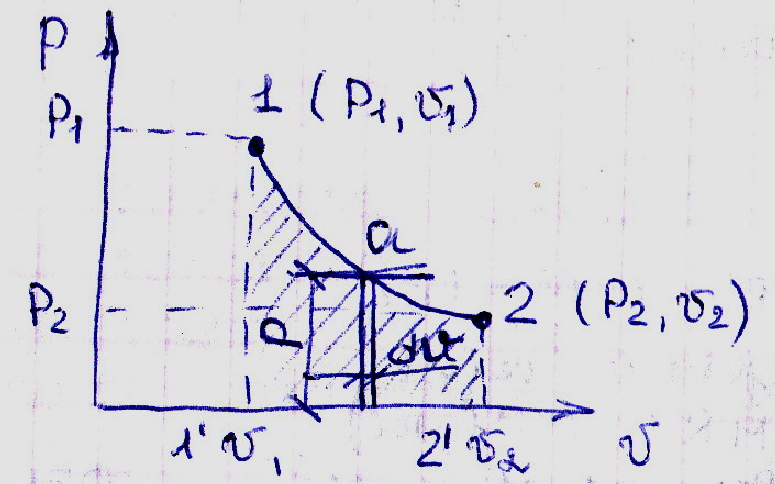
Выделим уч-к процесса 1-2, в котором происходит бесконечно малое изменение dv удельного объёма рабоч. тела. Давление на этом уч-ке равно текущей ординате p. Первоначальн. Объём газа- V1. Произведение pdV имеет размерность работы (l), производимой 1 кг рабочего тела, Дж/кг.
dl=pF ds,
где p- переменное давление газа на поршень, Па
F-площадь поршня, м2
s- перемещение поршня,м
Работа расширения l Дж/кг, рабочего тела в процессе 1-2:
dl=p∙dv
l=∫pdv
Работа газа в процессе расширения считается положительной.
При уменьшении объёма газа, когда поршень будет двигаться справа налево, получим процесс сжатия газа. Совершаемая при этом работа наз. работой сжатия газа.Она считается отрицательной. Работа зависит от характера протекания процесса и явл. его фун-ей и не зависит от состояния.
Работа 122'1'- положит.
121'2'б- отриц.
6.Теплоёмкость газа.
Теплоёмкость(С)- кол-во теплоты (тепловой энергии), необходимой для нагрева тела на 10С. Измеряется в Дж/К, Дж/ 0С.
Удельная теплоёмкость – теплоёмкость, отнесённая к некоторой количественной единице(кг, моль, м3).
С, Дж/кг∙К – массовая теплоёмкость
С', Дж/м3∙К – объёмная теплоёмкость
µС, Дж/к моль∙К – киломольная теплоёмкость
Между ними имеют место след. Отношения:
С= µС/22,41;
С'=ρС
Кол-во теплоты, подводимой для повышения температуры на 10С, зависит от характера процесса.
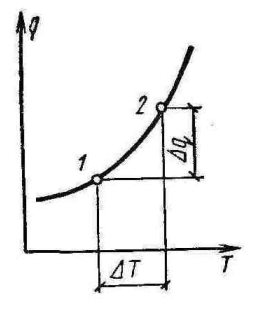
С= dq/dt - истинная или мгновенная теплоёмкость.
Истинная теплоёмкость при данной темп-ре представляет собой предел, к которому стремится теплоёмкость, средняя для прилегающего температурного интервала, когда этот интервал стремится к нулю.
dq=Cdt
T1→T2 q=∫Cdt
Cm| T1T2=q/T2-T1
Cm| T2T1=∫Cdt/T2-T1=(Cm|0T2∙T2-Cm|T10∙T1)/T2-T1
Cm=∆q/∆T – средняя теплоёмкость
Нагревание(охлаждение ) при постоянном объёме – изохорная теплоём.(Сv)
Нагревание(охлаждение ) при постоянном давлении – изобарная теплоём.(Сp)
![]()
7. Газовые смеси.
В теплотехнике гораздо чаще приходится иметь дело не с однородным газом, а со смесью нескольких газов (например, с воздухом, природным газом, продуктами сгорания топлива и др.). Под смесью идеальных газов понимается механическая смесь различных газов при условии отсутствия в них химических реакций, т. е. химически между собой не взаимодействующих. Смесь идеальных газов тоже подчиняется всем законам, относящимся к идеальным газам.
Для удобства решения практических задач со смесями газов введено понятие о кажущейся молекулярной массе смеси газов. Под последней понимается средняя масса из действительных молекулярных масс отдельных компонентов, составляющих смесь.
Кажущаяся молекулярная масса смеси газов может быть определена из уравнения
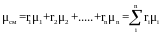
где r1,r2, ..., rn — объемные доли компонентов.
Уравнение состояния смеси газов выводится на основании уравнений состояния отдельных компонентов смеси и имеет вид
PV = GRCMT,
где Rсм — газовая постоянная смеси.
Для того, чтобы можно было пользоваться уравнением, следует определить величину газовой постоянной смеси RCM. Если известны массовые доли отдельных компонентов смеси, то газовая постоянная ее может быть определена по уравнению
RCM=g R
R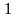 + g
+ g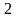 R2+
---+gnRn =
R2+
---+gnRn =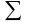 giRi,
giRi,
где g1, g2, g3, …, gn — массовые доли компонентов
Газовую
постоянную смеси, Дж/(кг*К), можно найти
также по формуле Rсм = 8314/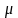 см.
см.
Например, для одной из самых распространенных смесей воздуха— =28,97кг/моль, а следовательно, Rсм=287,7Дж/(кг*К)
Закон Дальтона
Pсм=∑Pi
Pi- парциальное давление отдельного компонента - давление оказывающее о стенки сосуда при t и v газовой смеси.
8. 1-ый закон термодинамики, его матем. выражение.
1-вый закон термодинамики явл. частным случаем всеобщего закона сохранения и превращения энергии.
Этот закон устанавливает осн. положения взаимопревращения теплоты и мех. работы, а также эквивалентность этих превращений.
L/Q=I = const,
где I— механический эквивалент теплоты, обратная величина которого 1/I=А называется тепловым эквивалентом механической энергии (работы).
В системе единиц СИ теплота и работа измеряются в джоулях (Дж), эквиваленты энергии становятся равными единице и Q = L.
Т.о., первый закон термодинамики явл. одной из конкретных формулировок закона сохранения и превращения энергии. Формулировка: любая форма движ. способна и вынуждена при определенных для каждого случая условиях превращаться, прямо или косвенно, в любую другую форму движения.
Матем. формулировку мы получим, анализируя следующий пример. Допустим, что в цилиндре с подвижным поршнем находится 1 кг рабочего тела. Если к этому рабочему телу подвести q, Дж, теплоты, то состояние его изменится, поршень перейдет в другое положение и рабочее тело при этом совершит L, Дж, работы. Разница между колич. теплоты, подведенной к рабочему телу, и совершенной им работой выражает изменение внутр. энергии тела. q-L=U2-U1; q=(U2-U1)+L
Для бесконечно малого изменения состояния рабочего тела (газа) имеем
dq = du + dl,
где dq — бесконечно малое количество теплоты, Дж/кг; du — бесконечно малое изменение внутренней энергии рабочего тела, Дж/кг; dl — бесконечно малое количество совершаемой работы, Дж/кг.
Полученные уравнения являются аналитическим выражением первого закона термодинамики, который формулируется так: если к газу подведено некоторое количество теплоты, оно расходуется на изменение внутренней энергии и на работу расширения газа.
Если в термодинамическом процессе находится не один, a G кг рабочего тела, то -количество участвующей в процессе теплоты Q, Дж, будет Q = Gg
-количество совершаемой работы L, Дж,L = Gl,
-изменение внутренней энергии, Дж, U2-U1=G(u2-u1).
