
- •1.Идеальный газ, определение и свойства.
- •2.Термодинамическая система, термодин. Процесс, параметры идеал. Газа.
- •3.Уравнение состояния идеального газа. Физический смысл газовой постоянной.
- •4.Внутренняя энергия идеального газа. Параметр состояния.
- •5.Работа газа . Параметр процесса.
- •6.Теплоёмкость газа.
- •7. Газовые смеси.
- •9. Выражение 1-ого закона термодинамики для различных процессов.
- •10.Круговые циклы. Термодин. И холодильный коэф.
- •11. Цикл Карно. Теорема Карно.
- •12. Реальный газ. Парообразование в координатах pv. Теплота парообразования. Степень сухости пара.
- •13. Влажный воздух. Его св-ва.
- •15. Темпер. Поле тела. Темпер. Градиент.
- •16.Теплопроводность. Закон Фурье.
- •17. Теплопроводность плоской стенки. Осн. Ур-ние теплопроводности.
- •19. Опред. Коэф. Теплоотдачи с использ. Критериальных ур-ний.
- •20.Лучистый теплообмен. Ур-ние Стефана-Больцмана.
- •21. Закон Кирхгофа, Ламберта.
- •22. Теплоотдача. Определение процесса. Ур-ние и коэф. Теплоотдачи для плоской стенки.
- •23. Теплообменные аппараты. Опред. Поверх. Нагрева.
- •24. Микроклимат помещений.
- •25.Сопротивление теплопередачи.
- •26. Теплоустойчивость ограждений. Коэффициент теплоусвоения s. Величина тепловой инерции d.
- •27. Воздухопроницаемость ограждений. Сопротивление воздухопроницаемости ограждений.
- •28.Определение тепловых потерь через ограждения
- •29. Определение тепловых потерь здания по укрупненным измерителям.
- •30. Системы отопления: осн. Элем., классификация, требования к отопит. Установке.
- •31. Система водяного отопления с естественной и искусств. Циркуляцией. Основные схемы.
- •34.Трубопроводы систем ценнтрального отопления, их соединения.
- •35.Расширительный бак.
- •36.Воздухоудаление.
- •37. Системы парового отопления. Принцип работы, классификация, основные схемы. Воздухоудаление из систем парового отопления. Область применения систем газового отопления.
- •38.Нагревательные приборы систем центр. Отопления.
- •39.Размещение отопительныхых приборов.
- •40. Выбор типа нагревательных приборов и определение их поверхности нагрева.
- •41. Особенности расчета поверхности нагревательных приборов для однотрубной системы отопления.
- •42.Регулировка теплоотдачи нагр. Приборов.
- •43. Топливо.
- •44. Горение топлива. Теоретический и действительный объем воздуха, необходимый для горения воздуха.
- •47. Централизованное теплоснабжение. Схема тэц.
- •48.Присоединение местных сист. Отопления к тепл. Сетям
- •49.Назначение и классификация систем вентиляции, воздухообмен, способы его определения.
- •50. Естественная вентиляция: инфильтрация, аэрация, канальная система венциляции.
- •51.Аэродинамический расчет естественной вытяжной системы вентиляции.
- •52. Механические системы вентиляции.
- •53.Устройства для очистки воздуха.
- •54. Устройства для подогрева воздуха.
- •55. Вентиляторы: классификация, принцип действия осевых и центробежных вентиляторов. Подбор вентиляторов.

1.Идеальный газ, определение и свойства.
Газы, молекулы которых не обладают силами взаимодействия, а сами молекулы представляют собой материальные точки с ничтожно малыми объёмами, называются идеальными газами. Понятие об идеальном газе введено для упрощения изучения термодинамических процессов и получения более простых расчётных формул.
Свойства идеального газа на основе молекулярно-кинетических представлений определяются исходя из физической модели идеального газа, в которой приняты следующие допущения:
•объём частицы газа равен нулю (то есть диаметр молекулы пренебрежимо мал по сравнению со средним расстоянием между ними) ;
•импульс передается только при соударениях (то есть силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударениях);
•суммарная энергия частиц газа постоянна (то есть нет передачи энергии за счет передачи тепла или излучением);
•время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями;
2.Термодинамическая система, термодин. Процесс, параметры идеал. Газа.
Непрерывное изменение состояния рабочего тела в результате взаимодействия его с окруж. средой наз. термодинамическим процессом
Различают равновесные и неравновесные процессы. Процесс, протекающий при значительной разности t и давлений окружающей среды и рабочего тела и неравномерное их распределение по всей массе тела, наз. неравновесным. Если же процесс происходит бесконечно медленно и малой разности t окруж. среды и рабочего тела и равномерного распределения t и давления по всей массе тела, наз. равновесным.
К осн. параметрам состояния газов относятся: давление, t и удельный объем.
Давлением наз. сила, действующая на единицу площади поверхности тела перпендикулярно телу.
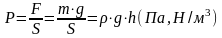
Давление газа есть результат силового воздействия молекул газа на внутр. поверхность сосуда, в ктр. заключен газ. В технике различают абсолютное давл., избыточное давл. и разрежение. Под абсолютным давлением подразумевается полное давление, под которым находится газ.
Рабс=Рб+gph, gph=Ризб
Где Рабс- абсолютное (полное) давление газа в сосуде, Рб- атмосферное давление в барометре, g- ус. св. пад. в точке измерения, p- плотность жидкости, h-высота столба жидкости.
Под избыточным давлением понимают разность между абсолютным давлением, большим, чем атмосферное, и атмосферным давлением. Разрежение (вакуум) характеризуется разностью между атмосферным давлением и абсолютным давлением, меньшим, чем атмосферное.
Температура-мера кинетической энергии хаотического движения молекул рабочего тела. Температура - параметр, характеризующий тепловое состояние тела. Температура тела определяет направление возможного самопроизвольного перехода тепла от тела с большей температурой к телу с меньшей температурой.
Для измерения температур приняты стоградусная шкала и абсолютная термодинамическая шкала Кельвина . В стоградусной шкале при pб =101,325кПа(760 мм.рт.ст.) за 00 принимается температура таяния льда, а за 100С – температура кипения воды. Градус этой шкалы обозначается через 0С.
Удельным объемом, v, м3/кг, называется объем единицы массы газа, т. е.
v=V/m где V- полный объем газа, м3; m - масса газа, кг, Обратная величина, кг/м3,P=G/V явл. Плотностью, представляющей собой количество вещества, заключенного в 1 м3, т. е. массу единицы объема.
Кроме рассм. осн. параметров сущ.: энтропия S, внутренняя энергия U и энтальпия i.
