
- •Маркеры в-клеток
- •Леточный иммунный ответ. Гуморальный иммунный ответ. Защитные функции иммуноглобулинов ( антител ).
- •Гуморальный иммунный ответ
- •Механизм действия
- •Формирование и размножение цитотоксических т-лимфоцитов
- •8. Выброс продуктов деградации.
- •Антигенпрезентирующие клетки (апк)
- •Компоненты системы комплемента
- •Основные этапы активации системы комплемента.
- •Биологические функции
- •Классический путь
- •Альтернативный путь
- •Лектиновый (маннозный) путь активации системы комплемента
- •Роль системы комплемента при болезнях
- •Агаммаглобулинемия
- •Селективный IgA-дефицит
- •Вторичные иммунодефициты
- •Причины
- •Классификация
- •Стадии инфекционного процесса
- •Антитела к вич
- •Клинические стадии, классификация вич/спид
- •Клиническая классификация вич-инфекции в рф
- •Система ab0
- •Система Rh (резус-система)
- •Резус-фактор
- •Номенклатура Rh
- •Технология
- •Аллергия лекарственная : ложно-аллергические реакции
- •Ложная аллергия (псевдоаллергия)
- •Иммуноконфликтная беременность. Механизмы развития гемолитической болезни плода
- •Этиология и патогенез
- •Клиника
- •Лечение
- •Реакции гиперчувствительности третьего типа ( III типа ). Иммунокомплексный тип реакций. Феномен Артюса.
- •Реакции гиперчувствительности четвертого типа ( IV типа ). Гиперчувствительность замедленного типа. Реакции гиперчувствительности замедленного типа.
- •Классы hla
- •Отторжение трансплантанта. Реакция отторжения трансплантата. Клеточные реакции отторжения трансплантата. Аллоантитела. Типирование антигенов ( Аг ).
- •Клеточные реакции отторжения трансплантата
- •Аллоантитела
- •Типирование антигенов ( Аг )
- •Подбор тканей в системе «донор-реципиент»
- •Реакция трансплантат против хозяина. Кожные проявления реакции трансплантат против хозяина.
- •Механизм действия
- •Иммунологический надзор: преодоление его опухолевыми клетками
- •Опухолевые клетки и иммунитет: введение
- •Иммунный ответ противоопухолевый
- •Опухолеассоциированные антигены и иммунный ответ: введение
- •Натуральные киллеры: роль в иммунологическом надзоре
- •Ранняя диагностика
- •Возможные причины
- •Механизм развития
- •Прямая реакция Кумбса
- •Непрямая реакция
- •Реимущества
- •Иммунология
- •Сущность и классификация
- •Оценка иммунорегуляторного звена. Показатели иммунорегуляторного звена иммунитета
- •Методика определения групп крови
- •При работе с 3-я сыворотками групп о(I), а(II), в(III) возможны 4 комбинации реакций:
- •Определение резус-принадлежности крови
- •Клиническое значение определения циркулирующих иммунных комплексов (цик)
- •Кожные пробы
Иммунитет (определение). Врожденный и приобретенный (адаптивный) иммунитет. Структура иммунной системы.
Иммунитет (лат. immunitas — освобождение, избавление от чего-либо) — невосприимчивость, сопротивляемость организма инфекциям и инвазиям чужеродных организмов (в том числе — болезнетворных микроорганизмов), а также воздействию чужеродных веществ, обладающих антигенными свойствами. Иммунные реакции возникают и на собственные клетки организма, измененные в антигенном отношении.
Обеспечивает гомеостаз организма на клеточном и молекулярном уровне организации. Реализуется системой иммунитета.
Биологический смысл иммунитета — обеспечение генетической целостности организма на протяжении его индивидуальной жизни. Развитие иммунной системы обусловило возможность существования сложно организованных многоклеточных организмов.
Иммунитет делится на врождённый и приобретенный.
Врождённый (неспецифический, конституционный) иммунитет обусловлен анатомическими, физиологическими, клеточными или молекулярными особенностями, закрепленными наследственно. Как правило, не имеет строгой специфичности к антигенам, и не обладает памятью о первичном контакте с чужеродным агентом. Например:
Все люди невосприимчивы к чуме собак.
Некоторые люди невосприимчивы к туберкулёзу.
Показано, что некоторые люди невосприимчивы к ВИЧ.
Приобретенный иммунитет делится на активный и пассивный.
Приобретенный активный иммунитет возникает после перенесенного заболевания или после введения вакцины.
Приобретенный пассивный иммунитет развивается при введении в организм готовых антител в виде сыворотки или передаче их новорожденному с молозивом матери или внутриутробным способом.
Также иммунитет делится на естественный и искусственный.
Естественный иммунитет включает врожденный иммунитет и приобретенный активный (после перенесенного заболевания). А также пассивный при передаче антител ребёнку от матери.
Искусственный иммунитет включает приобретенный активный после прививки (введение вакцины) и приобретенный пассивный (введение сыворотки)
Выделяют центральные и периферические органы иммунной системы. К центральным органам относят красный костный мозг и тимус, а к периферическим - селезенку, лимфатические узлы, а также местноассоциированную лимфоидную ткань: бронхассоциированную (БАЛТ), кожноассоциированную (КАЛТ), кишечноассоциированную (КиЛТ, пейеровы бляшки).
Красный костный мозг — центральный орган кроветворения и иммуногенеза. Содержит самоподдерживающуюся популяцию стволовых клеток. Красный костный мозг находится в ячейках губчатого вещества плоских костей и в эпифизах трубчатых костей. Здесь происходит дифференцировка В-лимфоцитов из предшественников. Содержит также Т-лимфоциты.
Тимус — центральный орган иммунной системы. В нем происходит дифференцировка Т-лимфоцитов из предшественников, поступающих из красного костного мозга.
Лимфатические узлы — периферические органы иммунной системы. Они располагаются по ходу лимфатических сосудов. В каждом узле выделяют корковое и мозговое вещество. В корковом веществе есть В-зависимые зоны и Т-зависимые зоны. В мозговом есть только Т-зависимые зоны.
Селезёнка — паренхиматозный зональный орган. Является самым крупным органом иммунной системы, кроме того, выполняет депонирующую функцию по отношению к крови. Селезёнка покрыта капсулой из плотной соединительной ткани, которая содержит гладко-мышечные клетки, позволяющие ей при необходимости сокращаться. Паренхима представлена двумя функционально различными зонами: белой и красной пульпой. Белая пульпа составляет 20 %. Представлена лимфоидной тканью. Здесь имеются В-зависимые и Т-зависимые зоны. И также здесь есть макрофаги. Красная пульпа составляет 80 %. Она выполняет следующие функции:
Депонирование зрелых форменных элементов крови.
Контроль состояния и разрушения старых и повреждённых эритроцитов и тромбоцитов.
Фагоцитоз инородных частиц.
Обеспечение дозревания лимфоидных клеток и превращение моноцитов в макрофаги.
Функции иммунной системы, концепция иммунного надзора. Современные теории иммунитета. Клонально-селекционная теория Бернета, теория «сетей» Йерне.
Клонально-селекционная теория иммунитета Бернета.
Клонально-селекционная теория имеет в виду то, что каждый лимфоцит синтезирует антитела только одной определенной специфичности. И эти антитела располагаются на поверхности этого лимфоцита в качестве рецепторов.
Как показывают опыты, все поверхностные иммуноглобулины клетки имеют одинаковый идиотип: когда растворимый антиген, похожий на полимеризованный флагеллин, связывается со специфической клеткой, то все иммуноглобулины клеточной поверхности связываются с данным антигеном и они имеют одинаковую специфичность то есть одинаковый идиотип.
Антиген связывается с рецепторами, затем избирательно активирует клетку с образованием большого количества антител. И так как клетка синтезирует антитела только одной специфичности, то эта специфичность должна совпадать со специфичностью начального поверхностного рецептора.
Специфичность взаимодействия антител с антигенами не абсолютна, они могут в разной степени перекрестно реагировать с другими антигенами. Антисыворотка, полученная к одному антигену, может реагировать с родственным антигеном, несущим одну или несколько одинаковых или похожих детерминант . Поэтому каждое антитело может реагировать не только с антигеном, который вызвал его образование, но и с другими, иногда совершенно неродственными молекулами. Специфичность антител определяется аминокислотной последовательностью их вариабельных областей.
Клонально-селекционная теория:
Антитела и лимфоциты с нужной специфичностью уже существуют в организме до первого контакта с антигеном.
Лимфоциты, которые участвуют в иммунном ответе, имеют антигенспецифические рецепторы на поверхности своей мембраны. У B-лимфоцитов рецепторы- молекулы той же специфичности, что и антитела, которые лимфоциты впоследствии продуцируют и секретируют.
Любой лимфоцит несет на своей поверхности рецепторы только одной специфичности.
Лимфоциты, имеющие антиген, проходят стадию пролиферации и формируют большой клон плазматических клеток . Плазматические клетки синтезируют антитела только той специфичности, на которую был запрограммирован лимфоцит-предшественник. Сигналами к пролиферации служат цитокины, которые выделяются другими клетками. Лимфоциты могут сами выделять цитокины.
Первую, чисто биологическую, селективную теорию образования антител сформулировал Ерне, он предположил, что в организме синтезируется полный набор антител, но каждое из них образуется в небольшом количестве и независимо от какого-либо стимула поступает в кровь в виде естественных антител. Функция их состоит в том, чтобы избирательно связываться с соответствующим антигеном и таким способом доставлять его неким клеткам организма, для которых они служат сигналом к воспроизведению таких же молекул, т.е. к образованию антител. С этой точки зрения вторичный антительный ответ получал простое объяснение как результат появления после первой иммунизации увеличенного числа антител-носителей, присутствие которых будет одновременно способствовать селекции антигеном антител с более высоким сродством, что объясняет изменение качества антител при многократной иммунизации. Это была первая теория, которая объясняла также феномен иммунологической толерантности, принимая, что любые естественные антитела направленные против собственных антигенов будут немедленно абсорбироваться тканями организма, и таким образом не могут запустить образование аутоантител. Теория естественного отбора, предложенная Эрне, привлекла на свою сторону лишь немногих приверженцев инструктивных теорий, однако она имела большое историческое значение, т.к. дала стимул для теоретиков биологического направления таких как Вернет. Он использовал представления Эрлиха и Эрне о предсуществовании антител разной специфичности, но указывал на то, что каждое специфическое антитело синтезируется отдельным клоном клеток. По Бернету, при дифференцировке лимфоцитов от стволовой кроветворной клетки и при параллельном процессе мутационных изменений в генах, контролирующих синтез специфических антител возникают клоны клеток, которые способны взаимодействовать только с антигеном соответствующей специфичности. В результате такого взаимодействия формируется отобранный по специфичности клон, который либо секретирует антитела заданной специфичности, либо обеспечивает строго специфическую клеточную реакцию. Клональный селекционный признак организации иммунной системы выдвинутый Бернетом полностью подтвердился в настоящее время. Недостатком теории является представление о том, что многообразие антител возникает только за счет мутационного процесса.
Основным вкладом Й. в иммунологию стала теория «сетей», представленная им в 1974 г. На сегодняшний день это самая детально разработанная и логичная концепция, объясняющая процессы мобилизации организма на борьбу с болезнью, а затем, когда болезнь побеждена, его возвращение в неактивное состояние. Е. подчеркивал, что разновидностей антител гораздо больше, чем белков, и «в динамическом состоянии наша иммунная система в основном замкнута на самой себе, вырабатывая антиидеотипные антитела к собственным антителам (т.е. антитела, соответствующие антигенному профилю собственных антител)». Поэтому реакция на инородное тело – это не просто усиленное образование того или иного антитела, а определенное «нарушение порядка» в чрезвычайно сложной саморегулирующейся системе.
Мукозоассоциирования лимфоидная ткань, её строение, функции. Секреторный IgA, строение, функции.
Ткань лимфоидная мукозассоциированная (МАЛТ) — лимфоидные ткани слизистых желудочно-кишечного, дыхательного и урогенитального трактов. Под слоем мукозного эпителия располагаются Пейеровы бляшки и лимфатические узлы.
В тропических странах тоже есть экономика и там можно вести дела. Открыть бизнес на Пхукете может любой предприимчивый человек.
Эти лимфоидные образования и объединяются под общим названием лимфоидная ткань, ассоциированная со слизистыми. В слизистой кишечника содержатся специализированные М-клетки, обеспечивающие транспорт антигенов от базальной мембраны в субэпителиальную область.
В последней локализуется большое количество лимфоцитов, особенно гамма/дельта CD8+ Т-клеток. В ламина проприа имеются все типы Т- и В-лимфоцитов, особенно IgA-синтезирующих, а также макрофагов и тучных клеток. В двух метрах слизистой кишечника содержится столько же лимфоцитов, сколько в совокупности в костном мозге, селезенке и лимфатических узлах. Иммунный ответ на инфекционные агенты, репродуцирующиеся в слизистых, развивается в основном по гуморальному типу.
В-лимфоциты дифференцируются и превращаются в плазматические клетки, продуцирующие специфические антитела, относящиеся к иммуноглобулинам разных классов. В случае образования иммуноглобулинов А они поступают в кровь или транспортируются через слизистую в форме секреторного sIgA, обеспечивающего противоинфекционную защиту слизистых. Избыточное образование антител IgE изотипа может привести к развитию аллергических реакций ГНТ I типа.
IgA сывороточный IgA составляет 15-20 % всей фракции иммуноглобулинов, при этом 80 % молекул IgA представлено в мономерной форме у человека. Секреторный IgA представлен в димерной форме в комплексе секреторным компонентом, содержится в серозно-слизистых секретах (например в слюне, слезах, молозиве, молоке, отделяемом слизистой оболочки мочеполовой и респираторной системы). Содержит 10-12 % углеводов, молекулярная масса 500 кДа.
![]()
|
Иммуноглобулины А (IgA) циркулируют в сыворотке крови (составляет 15-20% от всех Ig), а также секретируются на поверхность зпителиев. Присутствуют в слюне, слёзной жидкости, молоке и на поверхности слизистых оболочек.
М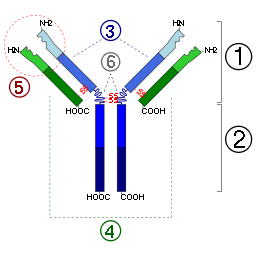 олекулы
IgA участвуют в реакциях
нейтрализации и агглютинации возбудителей.
Кроме того, после образования комплекса
Аг-АТ они участвуют в активации комплемента
по альтернативному пути.
олекулы
IgA участвуют в реакциях
нейтрализации и агглютинации возбудителей.
Кроме того, после образования комплекса
Аг-АТ они участвуют в активации комплемента
по альтернативному пути.
Дефицит IgA является одним из некорригируемых первичных дефектов иммунитета. Исправление данного дефекта состоит в лечении вторичных осложнений аллергической, аутоиммунной, либо инфекционной природы в совокупности с активацией сохранных элементов иммунитета с целью перекрытия недостатка продукции IgA (компенсации). Показаниями к проведению подобной иммуностимуляции являются преимущественно клинические проявления сниженной противоинфекционной сопротивляемости.
Известно, что уровень защиты от локальной вирусной инфекции желудочно-кишечного и респираторного трактов зависит не столько от наличия в организме сывороточного IgG к пневмотропным энтеропатогенным вирусам, сколько от содержания секреторного специфического иммуноглобулина A.
Отчетливый аффинитет к поверхностям слизистой оболочки, преобладание в секрете молочных желез, стабильная структура определяют биологическую значимость секреторного иммуноглобулина A в процессах защиты организма от агрессивного воздействия всевозможных патогенных агентов, в частности, вирусов.
Иммуноглобулин A в димерном виде синтезируют в lamina propria-клетках, а после связывания IgA с синтезированным в клетках эпителия иммуноглобулиновым рецептором транспортируют к поверхности слизистой оболочки. В момент появления IgA в просвете кишечника происходит частичное расщепление рецептора, вследствие чего IgA обогащается его фрагментом, именуемым секреторным компонентом. Очевидно, что секреторный IgA – совместный продукт клеток двух типов – эпителиальных и плазматических.
Способность секреторного иммуноглобулина А образовываться как в димерной, так и в тетрамерной формах значительно повышает его вирусонейтрализирующие свойства. Секреторный компонент защищает иммуноглобулин А от расщепления протеолитическим ферментом, что является его существенным преимуществом перед другими антителами. Секреторный IgA способен нейтрализовать вирус, как в просвете кишечника, так и во время транспортировки его внутрь клетки. Сначала димер иммуноглобулина А нейтрализует вирус в подслизистой кишечника, затем связывается с рецептором и транспортирует вирус в просвет кишечника.
Единая структура секреторного компонента и димерных иммуноглобулинов класса А, соединенная j-цепью является уникальным примером эволюционной адаптации иммуноглобулина на слизистых покровах, следствием чего является эффективное функционирование при постоянном воздействии антигенов разнообразной природы.
В различные внешние секреты, в том числе в молоко, молекулы иммуноглобулина A проникают из двух основных источников. IgA, выделяемый респираторным и пищеварительным трактами, секретами молочной и слезной желез, а также слюной, образуют плазматические клетки. Однако иммуноглобулин A, обнаруженный во внешних секретах может иметь происхождение и системного характера. Такой IgA продуцируется в клетках слизистой оболочки одного органа, поступает в кровь и переносится ею к слизистым покровам другого органа.
Проникнув в пейерову бляшку антиген активирует В- и Т-лимфоциты, используя лимфатический проток, те проникают сначала в мезентериальный лимфоузел, после чего в кровь, затем в селезенку и опять в кровь. Происходит их селективная локализация в лимфообразованиях слизистых оболочек, а также в секреторных железах экзокринной природы: слезных, молочных и слюнных. При этом локализация лимфоцитов происходит по большей части между клетками эпителия слизистой оболочки, что обеспечивает иммунный ответ клетки. Локализация В-лимфоцитов наблюдается преимущественно в lamina propria, где происходит их дифференциация в плазматические клетки, а также синтезируется иммуноглобулин A.
В-лимфоциты, их функции. Рецепторы зрелого В-лимфоцита. Популяции В-лимфоцитов.
B-лимфоци́ты (B-клетки, от bursa fabricii птиц, где впервые были обнаружены) — функциональный тип лимфоцитов, играющих важную роль в обеспечении гуморального иммунитета.
У эмбрионов человека и других млекопитающих B-лимфоциты образуются в печени и костном мозге из стволовых клеток, а у взрослых млекопитающих — в красном костном мозге.
При контакте с антигеном или стимуляции со стороны T-клеток некоторые B-лимфоциты трансформируются в плазматические клетки, способные к продукции антител. Другие активированные B-лимфоциты превращаются в B-клетки памяти.
Маркеры в-клеток
Характерной особенностью В-клеток является наличие поверхностных мембрано-связанных антител, относящихся к классам IgM и IgD. В комплексе с с другими поверхностными молекулами иммуноглобулины формируют антиген-распознающий рецептивный комплекс, ответственный за узнавание антигена. Также на поверхности В-лимфоцитов расположены антигены МНС класса II, важные в кооперации с Т-клетками, также на некоторых клонах В- лимфоцитов присутствует CD5 маркер, общий с Т-клетками. Рецепторы C3b компонента комплемента(Cr1, CD35) и C3d (Cr2,CD21) имеют определённую роль в активации В-клеток. Следует отметить, что маркеры CD19, CD20 и CD22 используются для идентификации В-лимфоцитов. Также на поверхности В-лимфоцитов обнаружены Fc рецепторы.
Лимфоциты происходят от полипотентных стволовых клеток, дающих также начало всем клеткам крови. Дифференцировка стволовых клеток крови по эритроидному, миелоидному либо лимфоидному пути зависит от микроокружения (в случае птиц дифференцировка стволовых клеток в В-лимфоциты происходит в фабрициевой сумке, у млекопитающих в костном мозге, где также происходит дифференцировка по миелоидному и эритроидному пути). Дифференцировка В-лимфоцитов условно делится на две стадии — антигеннезависимую (в которую происходит перестройка генов иммуноглобулинов и их экспрессия) и антигензависимую (при которой происходит активация, пролиферация и дифференцировка в плазматические клетки).
Пре-В-Клетки-предшественники не синтезируют тяжёлых и лёгких цепей, содержат зародышевые H и L гены, но содержат антигенный маркер, общий с зрелыми пре-В-клетками.
Ранние пре-В-клетки — D-J перестройки в Н генах.
Поздние пре-В-клетки — V-DJ перестройки в Н генах.
Большие пре-В-клетки Н-гены VDJ-перестроены; в цитоплазме имеются тяжёлые цепи класса μ.
Малые пре-В-клетки — V-J перестройки в L генах; в цитоплазме имеются тяжёлые цепи класса μ.
Малые незрелые В-клетки — L гены VJ-перестроены; синтезируют Н и L- цепи; на мембране расположены иммуноглобулины.
Зрелые В-клетки- начало синтеза IgD.
В-клетки поступают из костного мозга во вторичные лимфоидные органы (селезёнку и лимфатические узлы), где происходит их дальнейшее созревание, антиген-презентирование, пролиферация и дифференцировка в плазматические клетки и В-клетки памяти.
Экспрессия всеми В-клетками мембранных иммуноглобулинов позволяет осуществляться клональному отбору под действием антигена. При созревании, антиген-стимулировании и пролиферации существенно меняется набор маркеров В-клеток. По мере созревания В-клетки переключаются от синтеза IgM и IgD на синтез IgG, IgA, IgE (при этом у клеток сохраняется способность синтезировать также IgM и IgD- вплоть до трёх классов одновременно). При переключении синтеза изотипов антигенная специфичность антител сохраняется. Различают:
Собственно В-клетки (ещё называемые «наивными» В-лимфоцитами) - неактивированные В-лимфоциты, не контактировавшие с антигеном. Не содержат тельца Голла, в цитоплазме рассеяны монорибосомы. Полиспецифичны и имеют слабое сродство к многим антигенам.
В-клетки памяти - активированые В-лимфоциты, посредством кооперации с Т-клетками вновь перешедшие в стадию малых лимфоцитов. Являются долгоживущим клоном В-клеток, обеспечивая быстрый иммунный ответ и выработку большого количества иммуноглобулинов при повторном введении того же антигена. Названы клетками памяти, так как позволяют иммунной системе «помнить» антиген на протяжении многих лет после прекращения действия антигена. В-клетки памяти обеспечивают долговременный иммунитет.
Плазматические клетки - являются последним этапом дифференцировки активированных В-клеток, провзаимодействовавшими с антигеном. В отличие от остальных В-клеток несут мало мембранных антител и способны секретировать растворимые антитела. Являются большими клетками с эксцентрично расположенным ядром и развитым синтетическим аппаратом - шероховатый эндоплазматический ретикулум занимает почти всю цитоплазму, также развит и аппарат Гольджи. Являются короткоживущими клетками (2-3 дня) и быстро элиминируются при отсутствии антигена, вызвавшего иммунный ответ.
Иммуноглобулины (антитела). Строение, классы и субклассы иммуноглобулинов
Антитела (иммуноглобулины, ИГ, Ig) — это особый класс гликопротеинов, присутствующих на поверхности В-клеток в виде мембраносвязанных рецепторов и в сыворотке крови и тканевой жидкости в виде растворимых молекул. Они являются важнейшим фактором специфического гуморального иммунитета. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов — например, бактерий и вирусов. Антитела выполняют две функции: антиген-связывающую и эффекторную (вызывают тот или иной иммунный ответ, например, запускают классическую схему активации комплемента).
Антитела синтезируются плазматическими клетками, которыми становятся В-лимфоциты в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом — характерным фрагментом поверхности или линейной аминокислотной цепи антигена.
Антитела состоят из двух лёгких цепей и двух тяжелых цепей. У млекопитающих выделяют пять классов антител (иммуноглобулинов) — IgG, IgA, IgM, IgD, IgE, различающихся между собой по строению и аминокислотному составу тяжёлых цепей и по выполняемым эффекторным функциям.
Антитела являются относительно крупными (~150 кДа — IgG) гликопротеинами, имеющими сложное строение. Состоят из двух идентичных тяжелых цепей (H-цепи, в свою очередь состоящие из VH, CH1, шарнира, CH2 и CH3 доменов) и из двух идентичных лёгких цепей (L-цепей, состоящих из VL и CL доменов). К тяжелым цепям ковалентно присоединены олигосахариды. При помощи протеазы папаина антитела можно расщепить на два Fab (англ. fragment antigen binding — антиген-связывающий фрагмент) и один Fc (англ. fragment crystallizable — фрагмент, способный к кристаллизации). В зависимости от класса и исполняемых функций антитела могут существовать как в мономерной форме (IgG, IgD, IgE, сывороточный IgA) так и в олигомерной форме (димер-секреторный IgA, пентамер — IgM). Всего различают пять типов тяжелых цепей (α-, γ-, δ-, ε-и μ- цепи) и два типа легких цепей (κ-цепь и λ-цепь).
антиинфекционные или антипаразитарные антитела, вызывающие непосредственную гибель или нарушение жизнедеятельности возбудителя инфекции либо паразита
антитоксические антитела, не вызывающие гибели самого возбудителя или паразита, но обезвреживающие вырабатываемые им токсины.
так называемые «антитела-свидетели заболевания», наличие которых в организме сигнализирует о знакомстве иммунной системы с данным возбудителем в прошлом или о текущем инфицировании этим возбудителем, но которые не играют существенной роли в борьбе организма с возбудителем (не обезвреживают ни самого возбудителя, ни его токсины, а связываются со второстепенными белками возбудителя).
аутоагрессивные антитела, или аутологичные антитела, аутоантитела — антитела, вызывающие разрушение или повреждение нормальных, здоровых тканей самого организма хозяина и запускающие механизм развития аутоиммунных заболеваний.
аллореактивные антитела, или гомологичные антитела, аллоантитела — антитела против антигенов тканей или клеток других организмов того же биологического вида. Аллоантитела играют важную роль в процессах отторжения аллотрансплантантов, например, при пересадке почки, печени, костного мозга, и в реакциях на переливание несовместимой крови.
гетерологичные антитела, или изоантитела — антитела против антигенов тканей или клеток организмов других биологических видов. Изоантитела являются причиной невозможности осуществления ксенотрансплантации даже между эволюционно близкими видами (например, невозможна пересадка печени шимпанзе человеку) или видами, имеющими близкие иммунологические и антигенные характеристики (невозможна пересадка органов свиньи человеку).
антиидиотипические антитела — антитела против антител, вырабатываемых самим же организмом. Причём это антитела не «вообще» против молекулы данного антитела, а именно против рабочего, «распознающего» участка антитела, так называемого идиотипа. Антиидиотипические антитела играют важную роль в связывании и обезвреживании избытка антител, в иммунной регуляции выработки антител. Кроме того, антиидиотипическое «антитело против антитела» зеркально повторяет пространственную конфигурацию исходного антигена, против которого было выработано исходное антитело. И тем самым антиидиотипическое антитело служит для организма фактором иммунологической памяти, аналогом исходного антигена, который остаётся в организме и после уничтожения исходных антигенов. В свою очередь, против антиидиотипических антител могут вырабатываться анти-антиидиотипические антитела и т. д.
Гуморальный иммунный ответ, его стадии. Отличия при ответе на Т-лимфоцит-зависимые и Т-лимфоцит-независимые антигены.
