
- •Билет №1
- •Вопрос 1: Показатель политропы в изотермическом, изобарном, изохорном, адиабатном и политропных процессах.
- •Показатель политропы:
- •Вопрос 2: Законы гидрогазодинамики. Физические свойства жидкостей (газов).
- •Билет №2
- •Вопрос 1: Дифференциальное уравнение равновесия Эйлера (вывод). Основное уравнение гидростатики. Дифференциальные уравнения равновесия Эйлера
- •После преобразования находим:
- •Таким образом, условия равновесия элементарного параллелепипеда выражаются системой уравнений:
- •Основное уравнение гидростатики
- •Вопрос 2: Уравнения теплоемкостей в изотермическом, изобарном, изохорном, адиабатном и политропных процессах.
- •43.Уравнения изменений энтальпии в изотермическом, изобарном, изохорном, адиабатном и политропных процессах.
- •3.Основные характеристики движения жидкости. Гидравлический радиус и эквивалентный диаметр.
- •4.Дифференциальное уравнение для установившегося и неустановившегося потока.
- •42.Уравнения изменений внутренней энергии в изотермическом, изобарном, изохорном, адиабатном и политропных процессах.
- •5.Режимы движения жидкостей и расход жидкости при ламинарном движении потока.
- •41.Уравнения количества теплоты, сообщаемое в адиабатном и политропном процессах.
- •6.Дифференциальное уравнение неразрывности потока. Практическое приложение.
- •Вопрос 2
- •Работа при адиабатическом процессе
- •Расчёт теплоты и работы политропных процессов сжатия газов
- •Вопрос 7
- •7. Дифференциальное уравнение движения идеальной жидкости (уравнение эйлера).
- •Вопрос 2
- •9.Вывод уравнения Бернулли. Практическое применение.
- •9.Вывод уравнения Бернулли. Практическое применение.
- •Вопрос 2
- •10.Теория подобия – метод научного обобщения экспериментов.
- •Вопрос 2
- •11. Условия и теория подобия.
- •Вопрос 2
- •36.Простейшие термодинамические процессы идеальных газов.
- •4Адиабатный процесс
- •5. Политропный процесс
- •Вопрос 13
- •12. Первая теорема подобия. Преобразование дифференциального уравнения в критериальное. Подобие начальных и граничных условий
- •Вопрос 2
- •35.Параметр состояния термодинамической системы – энтропия. Вывод.
- •13. Вторая теорема подобия. Пример использования.
- •Вопрос 2
- •34. Второй закон термодинамики. Основные постулаты, вытекающие изз второго закона термодинамики.
- •14. Третья теорема подобия. Раскрыть ее сущность.
- •Вопрос 2
- •33.Уравнение Майера.
- •Вопрос 16
- •15. Преобразование дифференциального уравнения Навье-Стокса в критериальное. Гидравлическое подобие
- •Для установившегося потока
- •Вопрос 2
- •32.Первый закон термодинамики. Раскрыть сущность.
- •16. Модифицированные и производные критерии подобия
- •Вопрос 2
- •30.Работа и теплота
- •28. Внутренняя энергия системы. Внутренняя энергия идеального газа.
- •29. Энтальпия идеального газа.
- •19. Гидравлическое сопротивление при движении жидкостей (газов) в трубах и каналах.
- •26. Смеси идеальных газов. Массовая и молярная концентрация. Парциальное давление. Закон Дальтона.
- •21. Сопротивление при свободном движении тел в газах и жидкостях
- •22. Осаждение частиц под действием сил тяжести и инерции. Примеры применения.
- •Основные понятия о науке газодинамике
Вопрос 2: Уравнения теплоемкостей в изотермическом, изобарном, изохорном, адиабатном и политропных процессах.
Работой можно назвать термодинамический процесс совершаемый системой над внешними телами. dA=dpdV
Для перевода системы из одного состояния в другое с помощью различных термодинамических процессов , ей нужно сообщать определенное количество теплоты.
Теплота и работа являются функциями изменения системы.
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты Q, полученного телом, к соответствующему приращению его температуры T:
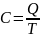 (1)
(1)
Единица измерения теплоёмкости в системе СИ — Дж/К.
Теплоемкость
зависит от массы тела, его химического
состава, термодинамических составляющих
и процесса сообщения теплоты
термодинамической системы.
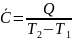 при Т2
при Т2 Т1 (2)
Т1 (2)
Связь
между (1) и (2):
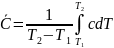 (3)
(3)
Удельная теплоемкость: С=с/М
Для
смеси N
газов:
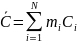
Молярной
(мольной) называется:
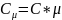 ,
где
,
где
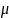 -
молярная масса.
-
молярная масса.
Элементарное количество теплоты, сообщаемое газом для его температуры от Т до Т+dT или dq=cdT.
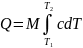
1 закон ТЕРМОДИНАМИКИ:
Количество теплоты, сообщаемое системе расходуется на изменение ее внутренней энергии и на совершение системой работы против внешних сил.
dQ=dV+dA; dQ=dV+pdV.
cdT=dU+pdV (1)
Если на систему равномерно распределяется внешнее давление и действуют другие силы, то:
cdT=dU+pdV+dR.
Изохо́рная теплоёмкость — теплоёмкость тела при изохорическом процессе.
![]() ,
где γ — показатель адиабаты,
R — универсальная
газовая постоянная.
,
где γ — показатель адиабаты,
R — универсальная
газовая постоянная.
А при постоянном давлении (изобарная теплоемкость):
![]()
R = 8.31 Дж/(моль К) — универсальная газовая постоянная.
i – Количество степеней свободы.
При изохорном: (dv/dt)=0; U=Mf (T)
При изобарном: (dv/dt)=M / * R/p
Уравнение Майера:
Сp – Сv = M / * R
CpM – CVM = R
Из инета:
МАЙЕРА УРАВНЕНИЕ
-
ур-ние, устанавливающее связь между
теплоёмкостями при пост, давлении Cp и
пост, объёме С V 1
кмоля идеального
газа:![]() где R- газовая
постоянная. Впервые
было получено Ю. P. Майером (J. R. Mayer) в 1842
и ещё до работ Дж. П. Джоуля (J. P. Joule)
использовано им для количеств,
определения механического
эквивалента теплоты. Для
произвольной массы т (кг)
вещества в состоянии идеального газа
M. у. записывается в виде:
где R- газовая
постоянная. Впервые
было получено Ю. P. Майером (J. R. Mayer) в 1842
и ещё до работ Дж. П. Джоуля (J. P. Joule)
использовано им для количеств,
определения механического
эквивалента теплоты. Для
произвольной массы т (кг)
вещества в состоянии идеального газа
M. у. записывается в виде: ![]() ,
где
,
где ![]() -
молекулярная масса газа. M. у. можно
получить из общего
соотношения
-
молекулярная масса газа. M. у. можно
получить из общего
соотношения ![]() (см. Термодинамика), если
учесть, что для идеального газа
справедливо Клапейрона
уравнение.
(см. Термодинамика), если
учесть, что для идеального газа
справедливо Клапейрона
уравнение.
В термодинамике используют так называемый термодинамический коэффициент адиабаты:
СV = R / K-1 * M / ;
CVM = R / K-1 ;
CV = R / (K-1)*M
Билет 3
43.Уравнения изменений энтальпии в изотермическом, изобарном, изохорном, адиабатном и политропных процессах.
1.Изотермический:
2.Изобарный:
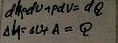
3.Изохорный: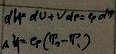
4.Адиабатный:
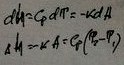
5.Политрропный:
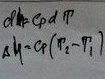
2 вопрос
3.Основные характеристики движения жидкости. Гидравлический радиус и эквивалентный диаметр.
Рассмотрим движение жидкости по трубе постоянного сечения.Количество жидкости, протекающей через поперечное сечение потока в единицу времени, называют расходом жидкости. Различают объемный расход (м3/с, м3/ч) и массовый расход (кг/ч, кг/с).
В разных точках поперечного сечения потока скорость частиц жидкости неодинакова.
В
расчетах обычно используют среднюю
скорость
(м/с):
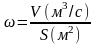 . (2.28)
. (2.28)
Массовый расход М (кг/с): M = S , (2.29)
где – плотность; – массовая скорость, W = .
Приведенные основные характеристики движения жидкостей относятся к их перемещению в каналах с сечением любой формы.
Гидравлический радиус и эквивалентный диаметр
При движении жидкости через площадь поперечного сечения любой формы, отличной от круглой, в качестве расчетного линейного размера принимают гидравлический радиус, или эквивалентный диаметр.
Гидравлический
радиус
rr
(м) – это отношение площади свободного
сечения
трубопровода или канала, через которое
протекает жидкость, к смоченному
периметру, т.е.
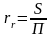 ,
(2.30)
,
(2.30)
где S – площадь сечения потока жидкости, м; П – смоченный периметр, м.
Для
круглой трубы диаметром d
получаем
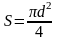 ,
, 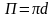 ,
, 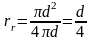 .
.
Диаметр, выраженный через гидравлический радиус, представляет собой эквивалентный диаметр: d = dэ = 4rr.
Таким образом, dэ = 4S/П . (2.31)
Эквивалентный диаметр dэ равен диаметру гипотетического трубопровода круглого сечения, для которого отношения площади S к смоченному периметру П то же, что и для трубопровода некруглого сечения.
Для
канала прямоугольного сечения со
сторонами a
и b,
полностью заполненного жидкостью,
гидравлический радиус равен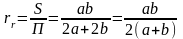 ,
а эквивалентный диаметр составляет
,
а эквивалентный диаметр составляет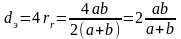 .
.
Для канала кольцевого поперечного сечения, в котором жидкость ограничена внутренней и наружной окружностями с диаметрами dв и dн соответственно, эквивалентный диаметр определяется как
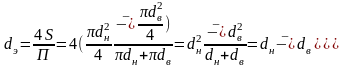 .
.
Для круглой трубы dэ=d.
Билет 4
