
- •Молекулярно-кинетические условия образования р-ра
- •Рассмотрим 3 основные стадии взаимодействия в-ва с рас-лем:
- •Диссоциация соединений различных классов.
- •Количественные характеристики процесса электролитической диссоциации.
- •Случай гидролиза:
- •Ионные реакции в растворах
- •Коллигативное (общее) свойство растворов
- •Понижение насыщенного пара рас-ля на рас-ом
- •Потенциал электрода
- •Элемент Даниэля-Якоби
- •Задача:
- •Kat восстановление окислителя происходит:
- •Элемент дифференциальной аэрации
- •Защита металлов от коррозии
- •Задача:
Kat восстановление окислителя происходит:
1.На постороннем металле, более электроположительным чем основной, и находящийся с основным в контакте.
2.На участке изделия, которое имеет более электроположительный потенциал.
Причинами всего этого могут быть:
1.Неоднородность сплава по химическому и фазовому составу.
2.Примеси в металле.
3.Механические напряжения, которые делают поверхность металла энергетически неоднородной.
В результате проявления какой-либо причины, появляется более или менее активные относительно друг друга участки поверхности.
В процессе коррозии происходит растворение анодного участка металла.
Освобожденные электроны перемещаются на катионный участок, где и поглощаются окислителем.
Особенности строения коррозионного ГЭ
1.Анод и катод нах-ся на поверхности корродирующего металла.
Анодами яв-ся участки с меньшим значением потенциала, а катионом с большим значением потенциала.
Катионный участок может быть другим металлом, либо тем же металлом, но имеющим электроположительную часть изделия (по причинам указанным выше).
2.Анод и катод имеют очень малые размеры и чередуются на поверхности.
3.Отсутствует внешняя электр. цепь и электроны двигаются на поверхности металла, не выходя из него.
Анализ возможности протекания коррозии
Что бы ответить на вопрос: «Протекает ли коррозия в указанных условиях, и если да, то по какому механизму, т.е. с кислородной или водородной деполяризацией» нужно:
1.Если в контакте находятся 2 металла, то какой анод, а какой катод, для этого сравниваем стандартные электронныйе потенциалы:
Ма °Мк
Мк °Ма
°Мк > °Ма
2.Выбор окислителя:
а)определение pH среды
б)рассчитать О2 и H2
О2 =1,23-0,059*pH
H2=-0,059*pH
3.Расчет ЭДС коррозионного элемента
Е = к - а
Е1= О2 - °Ма
Е2= H2 - °Ма
Чем больше ЭДС, тем более вероятна коррозия по этому механизму.
3.Составление схемы корр-го элемента

4.Процессы на электродах
А: Ма – z ӗ → Ма z+
К(Мк): восстановление выбор Ох в зависимости от pH
Задача:
Каким образом будет корродировать железо в месте контакта с медью в кислой среде (pH=3) и в щелочной (pH=9)?
1.Fe
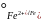 =
-0,44 В - анод
=
-0,44 В - анод
Cu
 =
+0,34 В - катод
=
+0,34 В - катод
2.а. pH=3
б. О2 =1,23-0,059*3=1,053 В >0
H2= -0,059 *3= -0,177 В >0
Коррозия со смешанной деполяризацией, более вероятна с кислородной.
3.Схема КГЭ
![]()
4. А: Fe-2ӗ=Fe2+
К(Cu): О2+4ӗ+4Н+→2Н2О
2Н++2ӗ→Н2↑
3Fe+O2+6H+→3Fe2++2H2O+H2↑
Щелочная среда
2.а. pH=9
б. О2 =1,23-0,059*9=0,70 В
H2= -0,059 *9= -0,53 В
Е1=0,70+0,44=1,14 В > 0
Е2= -0,53+0,44= -0,09 В < 0
Окислитель кислород
3.Схема КГЭ
![]()
4. А: Fe-2ӗ=Fe2+ /*2
К(Cu): О2+4ӗ+2Н2О→ 4OН-
2Fe+O2+2Н2О →2Fe2++4OН- (2Fe(OH)2↓)
Элемент дифференциальной аэрации
Концентрационный кислор. элемент, в котором разность потенциалов возникает из-за различной концентрации кислорода на электродах.
Такой элемент образуется если разные части одного и того же металла изделия не одинаково доступны кислороду. Как вследствие, активность их становится различной.
Участок менее доступный кислороду анод и растворяется. Участок более доступный – катод.
![]()
(
(А): Fe-2ӗ=Fe2+
К(Fe): О2+4ӗ+2Н2О→ 4OН-
2Fe+O2+2Н2 →2Fe2++4OН- (2Fe(OH)2↓)
Если есть щели, то начинается коррозия. На стыках труб или там, где есть резьба.
Язвенное разрушение металла над слоем ржавчины.
Образование ржавчины по ватерлинии (???)
