
- •Молекулярно-кинетические условия образования р-ра
- •Рассмотрим 3 основные стадии взаимодействия в-ва с рас-лем:
- •Диссоциация соединений различных классов.
- •Количественные характеристики процесса электролитической диссоциации.
- •Случай гидролиза:
- •Ионные реакции в растворах
- •Коллигативное (общее) свойство растворов
- •Понижение насыщенного пара рас-ля на рас-ом
- •Потенциал электрода
- •Элемент Даниэля-Якоби
- •Задача:
- •Kat восстановление окислителя происходит:
- •Элемент дифференциальной аэрации
- •Защита металлов от коррозии
- •Задача:
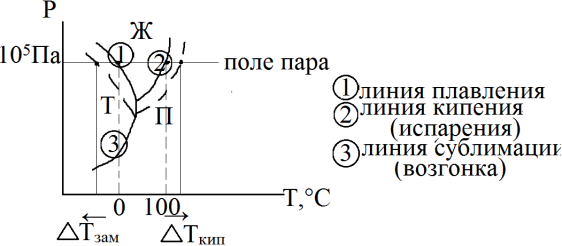
Понижение насыщенного пара рас-ля на рас-ом
Насыщенный пар – газообразная фаза, находящаяся в равновесии с жидким раствором. (пар равновес. с жидкостью)
Анализируя, Рауль обнаружил закономерности.
Давление насыщенного пара данного компонента над рас-ом равно давлению насыщенного пара этого компонента в чистом состоянии на его молярную долю в р-ре.
![]()
Обычно з-н Рауля применяют для определения давления пара рас-ля над рас-ом, содержащем не летучее растворенное в-во.
PA=PA°*XA
PH2O=PH2O°*XH2O (PH2O° - функция только температуры
Закон Рауля имеет объяснение: При XА=1, т.е. в чистом состоянии, давления пара = PА°. Преоб. р-ра молярная доля рас-ля уменьшается, т.е. уменьшается число частиц, переходящих в пар, следовательно, давление пара рас-ля над р-ром уменьшается.
ХА+ХВ=1
ХА=1-ХВ
![]()
Относительное понижение давления насыщенного пара рас-ля над разбавленным рас-ом не летучего в-ва равно молярной доле этого в-ва в р-ре.
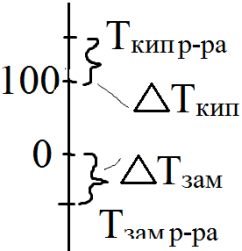
Повышение температуры кипения растворов
Всякая жидкость кипения при той температуре, при которой давление ее насыщенного пара достигает величины внешнего давления.
Ткип=Ткип р-ра-Т°Н2О
Ткип=Кэ*Сm(В)
Кэ – эбулистическая постоянная, зависит от природы рас-ля
Кэ(Н2О)=0,52 град*кг/моль
Физический смыл Кэ: Ткип=Кэ при Сm=1 моль/кг
Понижение температуры замерзания р-ра (ВТОРОЙ З-Н РАУЛЯ)
Температура замерзания – температура, при которой давление насыщенного пара над жидкостью и кристаллами жидкости одинаковые.
Тзам= Т°Н2О-Тзам р-ра
Тзам=Кк*Сm(В)
Кк – криоскопическая постоянная
Кк(Н2О)=1,86 град*кг/моль
Тзам=Кк при Сm=1 моль/кг
Коллигативные св-ва р-ров электролитов
В р-рах не электролитов концентрация частиц в р-ре совпадает с концентрацией растворенного в-ва.
Сч-ц=Сне элек
В р-рах электролитов вследствие неполной или полной диссоциации число частиц в р-ре больше их истинной концентрации.
Концентрация частиц в р-ре электролитов:
Сч-ц=i*Сэл-та
i – изотонический коэффициент, или коэффициент Вантгофа
Показывает во сколько раз возрастает концентрация частиц в результате диссоциации электролита и растворителя i=1+α(N-1), i=1÷N
α – степень диссоциации ; α=0÷1
N – число ионов на которые диссоциирует электролит
KCl, N=2; CrCl3, N=4, Al2S3, N=5
Pосм=i*103*C(В)*R*T

Ткип=i*Кэ*Сm(В)
Тзам=i*Кк*Сm(В)
Пример
1.Определите температуру замерзания р-ра 0,03 моль HCLO в 100г воды, если степень диссоциации кислоты = 5 %
Тзам=i*Кк*Сm(HClO)
Сm(HClO)=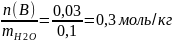
i=1+α(N-1)=1+0,05*1=1,05
HCLO=H++ClO-, N=2
Тзам=1,5*1,86*0,3=0,58°
Тзам=0-0,58=-0,58°C
2.Степень диссоциации Al2(SO4)3 в водном р-ре равна 75%, рассчитайте изотонический коэффициент
Al2(SO4)3= 2Al3++3SO42-, N=5
i=1+0,75(5-1)=4
Электрохимия
Опр. Электрохимия изучает законы взаимодействия и взаимосвязи химеских и электрических явлений.
Все электрохимические процессы можно разделить на основные группы:
1.Процессы превращения химической энергии в электрическую, это самопроизвольные процессы, проходящие в гальвонических элементах.
2.Процессы превращения электрической энергии в химическую, это не самопроизвольные процессы, к ним относится электролиз.
В зависимости от природы частиц, переносящих электричество, проводники делятся на:
-Проводники 1-го рода – это в-ва, в которых перенос электричества осуществляется электронами – это твердые и жидкие металлы, это некоторые не металлы, н-р, графит.
-Проводники 2-го рода – это системы, в которых перенос электричества осуществляется ионами – это р-ры электролитов, а так же расплавы солей.
Понятие электрода
Электрод – это проводник 1-го рода (металлическая пластина или стержень), находящаяся в контакте с проводником 2-го рода (растворами собственной соли) М/Мz – обозначается электрод.
Структура металла
Кристаллическая решетка металлов построена из катионов и относительно свободных валентных электронов, движущихся между катионами. Такую систему наз-ют эл-ый газ.
При этом число положительных зарядов катионов равно числу электронов.
При контакте металла с водой или раствором собственной соли происходит 2 процесса:
1.Полярные молекулы воды соответствующим образом ориентируются около катионов металлов на поверхности. Взаимодействуют с ними и вырывают их из металлической решетки.
![]()
Образование ионов металлов по такой реакции: M→Mz++Zӗ наз-ся окислением. Если прцесс происходит в р-ре, то наз-ся растворением.
Переход катиона в р-р нарушает электрическую нейтральность маталла и р-ра. Теперь металлическая поверхность приобрела избыточный отрицательный заряд, а р-р избыточный положительный заряд, за счет перешедших в него катионов.
2.Сольватированные катионы переходят и з р-ра в металл, теряя свою сольватную оболочку и входя в состав кристаллической решетки.
![]()
Переход ионов металла из р-ра в кристаллическую решетку по ур-ию Mz++Zӗ → M наз-ся восстановлением. Если процесс происходит в р-ре, то осаждением.
Через некоторый промежуток времени устанавливается динамичное равновесие, при котором скорость 1-го и 2-го процессов становятся равными. Имеет место электрохимическая реакция: MDMz++Zӗ
ДЭС
Катионы, оторвавшиеся от кристаллической решетки скапливаются у поверхности металла в концентрации, отвечающей равновесию, они не могут удалиться от поверхности вглубь р-ра, этому препятствует электростатическое притяжение их избыточными электронами на поверхности металла.
Вследствие притяжения образуется двойной электрический слой (ДЭС)
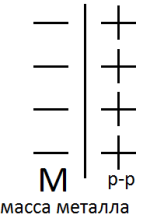
Одна сторона слоя представляет собой поверхность металла, другая ионы металла, находящиеся в р-ре у поверхности металла.
Между этими двумя сторонами слоя возникает разность потенциалов или скачок потенциалов или потенциал.
Величина потенциала для данного металла погруженного в р-р наз-ся потенциалом электрода , В.
Знак и величина потенциала электрода
Из анализа процессов растворения и осаждения металла следует, что величина и знак электродного потенциала зависят от соотношения прочности связи ионов в металле и энергии сольватации иона. Прочность связи ионов в металле характеризуется энергией разрушения кристаллической решетки Ем, а процесс сольватации – энергией сольватации Есол.
Схема ДЭС
1.Если Есол>Ем, то ионы металла будут переходить в р-р, в металле создается избыток электронов, а в р-ре избыточный положительных зарядов, тогда схема ДЭС:
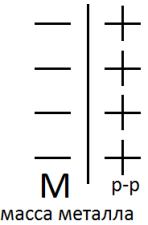
<0 (активные металлы)
2.Если Есол<Ем, то будет наблюдаться преимущественный переход иона из р-ра в металл. Металл приобретает положительный заряд, а р-р отрицательный.
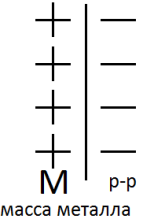
>0 (неактивные металлы)
Водородный электрод
Измерять абсолютное значение потенциала электрода пока нее удалось, поэтому определение потенциала производится относительно некоторого электрода сравнения. Для этого находят разность потенциалов измеряемого электрода и электрода сравнения, потенциал которого условно принимают равным 0. В силу ряда исторически сложившихся причин таким электродом сравнения выбран водородный электрод.
Водородный электрод представляет собой платиновую пластину, опущенную в р-р кислоты (HCl, H2SO4), покрытую губчатой платиновой чернью, которая насыщается газообразным водородом.
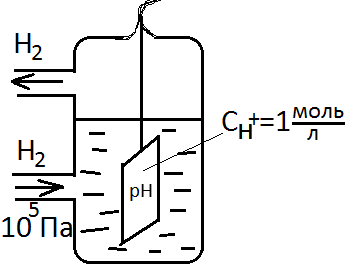
Находясь в соприкосновении с раствором молекула водорода распадается и анизируется, и ионы Н+ подобно ионам металла переходят в р-р. Одновременно происходит обратный процесс Н2D2Н++2ӗ
Пластина не принимает участия в электродной реакции, а служит для подвода и отвода электронов.
При стандартных условиях, а именно Сн=1 моль/л, РН2 Па, Т=298 К, потенциал водородного электрода равен 0. ° (фи нулевое). °(2Н+/Н2)=0 В. Водород электрода: Pt,H2/H+
