
- •Молекулярно-кинетические условия образования р-ра
- •Рассмотрим 3 основные стадии взаимодействия в-ва с рас-лем:
- •Диссоциация соединений различных классов.
- •Количественные характеристики процесса электролитической диссоциации.
- •Случай гидролиза:
- •Ионные реакции в растворах
- •Коллигативное (общее) свойство растворов
- •Понижение насыщенного пара рас-ля на рас-ом
- •Потенциал электрода
- •Элемент Даниэля-Якоби
- •Задача:
- •Kat восстановление окислителя происходит:
- •Элемент дифференциальной аэрации
- •Защита металлов от коррозии
- •Задача:
Ионные реакции в растворах
Поскольку электролиты в водных растворах существуют в виде ионов, то фактически реакции протекают между ионами, если в ходе реакции не изменяется степень окисления, то такие реакции наз-ся обменными
При составлении ионного уравнения все растворимые в-ва пишутся в ионной форме. Все газообразные, плохорастворимые и слабодис. В молекулярной.
Обменные реакции идут до конца если в процессе взаимодействия образуются в-ва, выходящие из зоны реакции, это газы, осадки, малодиссоциирующие в-ва.
1.NaCl+KNO3→?
Na++Cl-+K++NO3-= Na++NO3-+K++Cl-
Реакция взаимодействия нейтральная, в реак. Сосуде находится смесь ионов.
2.Na2SO4+BaCl2→?
Na2SO4+BaCl2→BaSO4↓+2NaCl
2Na++SO42-+Ba2++2Cl-→BaSO4↓+2Na++2Cl- (полное ионное уравнение)
SO42-+Ba2+→BaSO4↓ (сокращенное ионное уравнение-отражает суть процесса)
Эта реакция пойдет до конца, поскольку концентрации ионов SO42- и Ba2+ уменьшаются и выводится как продукт BaSO4
3.NaHCO3+HCl→NaCl+H2O+CO2↑
Na++HCO3-+H++Cl-→Na++Cl-+H2O+CO2↑
HCO3-+H+→H2O+CO2↑
Образуется вода и выделяется CO2
4.NaOH+HCl→NaCl+H2O – реакция нейтрализации
OH-+H+→ H2O (отражает суть реакции нейтрализации
Коллигативное (общее) свойство растворов
Опр. Св-ва р-ов, которые не зависят от природы растворенного в-ва, а определяются числом частиц в р-ре, наз-ся коллигативными св-ми.
К коллигативным св-ам относят:
1.Осмотическое давление
2.Понижение давления насыщенного пара р-ля над р-ом.
3.Повышение температуры кипения р-ра.
4.Понижение температуры замерзания р-ра.
Осмос – Это процесс односторонней диффузии р-ля через полупроницаемую перегородку от р-ра с меньшей концентрацией растворенного в-ва к р-ру с большей концентрацией.
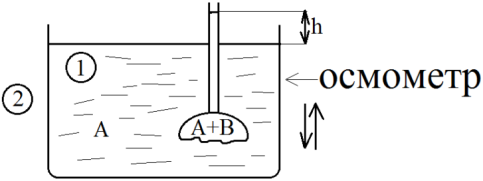
В сосуд 1 наливатся чистый рас-ль А. В сосуд 2 р-р А+В. Сосуд 2 внизу имеет полупроницаемую перегородку, которая наз-ся мембраной, которая может пропускать только молекулы рас-ля. Начинается процесс перемещения молекулы рас-ля внутрь сосуда 2, т.е. в р-р. Уровень жидкости в сосуде 2 поднимается над уровнем жидкости в сосуде 1 на высоту h.
Почему это происходит?
1.Стремление к выравниванию концентраций, поскольку концентрация СА в чистом рас-ле больше чем СА в р-ре.
2.Стремление к росту энропии, происходит разбавление р-ра, а следовательно увеличение его неупорядоченности.
3.Стремление к понижению энергии системы, а именно энергии сольватации, т.е. энергия взаимодействия АВ (ЕАВ) больше чем ЕАА (ЕАВ> ЕАА)
Через некоторое время замедляется движение молекул рас-ля внутри, устанавливается равновесие при котором скорости движения становятся равновесными, подъем жидкости прекращается.
Опр. Давление которое нужно приложить в процессе осмоса к р-ру, что бы привезти его уровень к уровню чистого рас-ля наз-ют осмотическим давлением. Осмотическое давление проявляется лишь в системе, состоящей из рас-ля, р-ра и полупроницаемой перегородки.
Р-ры, имеющие одинаковое осмотическое давление наз-ся изотоническими.
Анализируя результат изучения осмотического давления разных растворов, Вантгоф пришел к выводу, что растворенное в-во в очень разбавленном р-ре ведет себя подобно тому, как если бы оно находилось в газообразном состоянии при тех же условиях, т.е. к разбавленным р-рам применимо уравнение состояния идеального газа.
Росм*V=nRT
Росм=103*C*R*T (Па) – з-н Вантгофа
