
- •Молекулярно-кинетические условия образования р-ра
- •Рассмотрим 3 основные стадии взаимодействия в-ва с рас-лем:
- •Диссоциация соединений различных классов.
- •Количественные характеристики процесса электролитической диссоциации.
- •Случай гидролиза:
- •Ионные реакции в растворах
- •Коллигативное (общее) свойство растворов
- •Понижение насыщенного пара рас-ля на рас-ом
- •Потенциал электрода
- •Элемент Даниэля-Якоби
- •Задача:
- •Kat восстановление окислителя происходит:
- •Элемент дифференциальной аэрации
- •Защита металлов от коррозии
- •Задача:
Растворы
Общая характеристика растворов
Реакции называют гомогенными термодинамическими системами, состоящих из двух или большего числа компонентов, состав которых может изменяться в пределах допустимых растворимостью.
Различают газообразные, твердые и жидкие растворы.
Газообразные – смеси газов
Жидкие – смеси жидкостей или р-ры твердых в-в и газов в жидкостях (вода, водка).
Р-ры твердых в-в (соль).
Газы в жидкостях (соляная кислота).
Твердые р-ры представляют собой твердые фазы, получающиеся при охлаждении растворов или при окристализации из газовой фазы (металлические сплавы – монеты).
В р-ре различают: растворитель и растворенное в-во. Растворителем принято считать то в-во, которое имеется в р-ре в большем кол-ве.
Термодинамические условия образования р-ра
Образование р-ра пред. Собой самопроизвольный процесс, протекающий в открытой системе под влиянием двух внешних факторов (Р,Т). Такой процесс сапровождается убылью энергии Гипса.
Смешение в-в - это процесс разупорядочения.
Следовательно энтропия смещения положительная велечина.
Вывод: Термодинамическими условиями образования р-ов служит уменьшением энергии и увеличением энтропии.
Тепловой эффект растворения
1.Механизм растворения тв-ых в-в в жидкостях можно представлять в виде двух стадий: а) ориентация молекул растворителя вокруг частиц кристаллического в-ва с последующем разрывом связи, т.е. разрушением кристаллической решетки; б) сольвотация образующая ионов в р-ре.
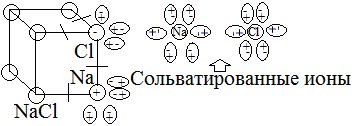
На первой стадии тепло, энергия затрачивается. На второй стадии тепло, энергия выделяется (сольватация).
От соотношения этих величин зависит общая теплота растворения.
Процесс растворителя может быть экзотермическим (преобладание эффекта сольватации) и эндотермическим (разрушение кристаллической решетки – затратно; н-р NaCl)
2.Растворение жидкостей.
В большинстве случаев сопровождается выделением теплоты (н-р ацетон, этиловый спирт). Но может происходить и с поглощением (уксусная кислота и вода), этиловый спирт с водой при смешивании при различных соотношениях и температурах меняет знак теплоты смешения.
3.Растворение газов в жидкостях сопровождается выделением теплоты. И она тем больше, чем лучше идет взаимодействие с растворителем.
Молекулярно-кинетические условия образования р-ра
Определяется: 1.Процессом диффузии частиц растворенного в-ва в р-ре. 2.Межмолекулярным взаимодествием.
Диффузия – направленное перемещение частиц движущей силой которого является градиент (разность) их концентраций.
Диффузия протекает до выравнивания концентраций во всех точках объема.
Самопроизвольный процесс растворения протекает с постепенным увеличением его концентрации до получения насыщенного р-ра.
С молекулярно-кинетической точки зрения р-р становится насыщенным когда скорость отрыва частиц от поваерхности твердого в-ва станет равной скоростям оседания частиц из р-ра на той же поверхности, т.е. когда имеет место динамическое равновесие: тв. в-во тв. в-во в р-ре.
Растворимость.
Способность одного в-ва растворителя в другом при заданных условиях имеет полное выражение называемое растворимостью.
Растворимость равна концентрации насыщенного при данных условиях р-ра.
Всякий р-р, концентрация которого при данных условиях меньше растворимости в-ва является не насыщенным.
При определенных условиях можно получить р-р, концентрация в-ва в котором больше растворимости (такой раствор перенасыщенный). Однако малейшее воздействие на такой р-р (перемешивание, добавление незначительного в-ва) вызывает выделение в-ва из р-ра, который происходит до тех пор пока концентрация р-ра не станет равной растворимости в-ва.
Поскольку понятие концентрации насыщенного р-ра связано с равновесием процесса растворения то следовательно этот процесс будет зависеть от температуры (Т). Насыщенный при одной температуре р-р при другой может оказаться перенасыщенным, или ненасыщенным.
Таком образом растворимость в-ва яв-ся функцией температуры (Т), а если растворимое в-во газообразно, то и функцией растворения газов над раствором.
Концентрация р-ов
Насыщенные р-ми приходится пользоваться сравнительно редко. Чаще на практике мы имеем дело с ненасыщенными р-ми, в этом случае мы пользуемся характеристикой концентрации.
Концентрация р-ра – кол-ная характеристика в-ва, растворенного в определенном объеме или массе р-ра или растворителя.
Существует приблизительная характеристика: концентратный р-р (растворено много в-ва) и разбавленный р-р.
Для точного охарактеризования р-ра существуют различные способы выражения контреций.
Способы выражения концентраций р-ов
1.Массовая доля – отношение массы в-ва (В) к массе р-ра.
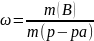 безразмерная
величина, меняется от 0 до 1 (0÷1).
Это истинное значение.
безразмерная
величина, меняется от 0 до 1 (0÷1).
Это истинное значение.
Существует представление это величины в процентах:
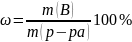 (0÷100%)
Истинное значение.
(0÷100%)
Истинное значение.
Масса р-ра
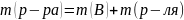 (m(р-ля)
– чаще всего вода)
(m(р-ля)
– чаще всего вода)
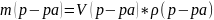 Св-вом
адитивности обладает масса, но не объем
(св-во суммироваться)
Св-вом
адитивности обладает масса, но не объем
(св-во суммироваться)
2.Молярная концентрация. Кол-во моль в-ва (B) в одном литре р-ра
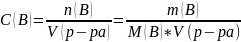
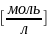
Иногда
[M]-
,
0,1M=0,1 (0,1 – децимолярная концентрация, 0,01М
сантимолярная концентрация.
(0,1 – децимолярная концентрация, 0,01М
сантимолярная концентрация.
m(B) – в граммах
V(р-ра) – в литрах
3.Молярная концентрация эквивалентов – это кол-во моль эк-ов в-ва (В) в одном литре р-ра.
Сэк
(В)=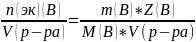 ,
,
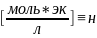
0,1н≡0,1
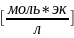
Сэк(В)=С(В)*Z
4.Моляльность – моляльная концентрация. Это кол-во моль в-ва(В) в одном килограмме растворителя.
Сm(В
)=
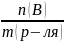 =
=

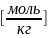
5.Титр. Это масса в-ва(В), содержащаяся в одном миллилитре р-ра.
Т(В)=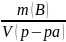 ,
,
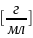
6.Молярная доля. Это отношение числа моль в-ва (В) к общему чмслу моль всех в-в, находящихся в р-ре, включая р-ль.
X(B)=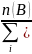
X(B)=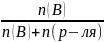 Величина безразмерная. 0÷1,
Величина безразмерная. 0÷1,
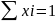
Задача:
Приготовлен
р-р 200мл воды и 10г борной кислоты H3BO3
. р-ра
=
1,2 г/мл,
воды
= 1 г/мл.
р-ра
=
1,2 г/мл,
воды
= 1 г/мл.
1.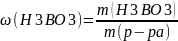 = 10/210 = 0,0476 (4,76%)
= 10/210 = 0,0476 (4,76%)
mр-ра – m(H3BO3)+m(H2O)=10+210=210г
2.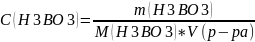 =10/62*0,175=0,92
моль/л
=10/62*0,175=0,92
моль/л
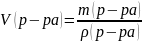 =210/1,2=175
мл
=210/1,2=175
мл
3.Сэк (H3BO3)=C(H3BO3)*Z(H3BO3)=2,76 моль*эк/л
4.Сm(H3BO3
)=
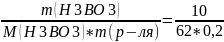 = 0,81
= 0,81

5.
Т(H3BO3)=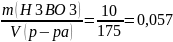
6.
X(H3BO3)= = 0,16/0,16+11,11 = 0,014
= 0,16/0,16+11,11 = 0,014
n(H3BO3) = 10/62 = 0,16 моль
n(H2O) = 200/18 = 11,11 моль
x(H2O) = 0,986
Теория образования р-ров
Физическая теория:
Сторонники: Аренеус, Оствальд, Вантгоф.
Процесс растворения рассматривается как равномерное распределение частиц растворенного в-ва по всему объему растворителя. Растворитель принимался за индифирентную (безразличную) среду.
Химическая теория:
Сторонники: Менделеев, Курганов.
Рас-ла р-ры как системы, образованные частицами рас-ля раств-го в-ва и неустойчивыми образованиями, которые возникают между р-рами и рас-ым в-вом при участии электростатических и межмолекулярных сил взаимодействия.
Современная теория:
Объединяет обе точки зрения и рассматривает процесс растворения как взаимодействие частиц разной полярности. Полярность молекул выражается в том, что силу неравномерного распределения электронной плотности в одной части молекулы могут преобладать положительные заряды, а в другой отрицательные.
Такое образование наз-ся диполем.
И растворители и растворенные в-ва могут быть и полярными и не полярными. Наиболее полярным рас-лем яв-ся вода и в силу этого яв-ся хорошим рас-лем различных полярных соединений. Процесс взаимодействия в-ва с рас-лем яв-ся сложным и состоящим из нескольких стадий, число которых зависит от природы в-ва и рас-ля.
