
- •Молекулярно-кинетические условия образования р-ра
- •Рассмотрим 3 основные стадии взаимодействия в-ва с рас-лем:
- •Диссоциация соединений различных классов.
- •Количественные характеристики процесса электролитической диссоциации.
- •Случай гидролиза:
- •Ионные реакции в растворах
- •Коллигативное (общее) свойство растворов
- •Понижение насыщенного пара рас-ля на рас-ом
- •Потенциал электрода
- •Элемент Даниэля-Якоби
- •Задача:
- •Kat восстановление окислителя происходит:
- •Элемент дифференциальной аэрации
- •Защита металлов от коррозии
- •Задача:
Потенциал электрода
Потенциал электрода, измеренный относительно водородного электрода при стандартных условиях Смz+=1 моль/л, р=105 Па, Т=298К, наз-ся стандартным электродным потенциалом. °(Мz+/М)
Если расположить стандартные электродные потенциалы металла в порядке их возрастания, то получится ряд стандартных электродных потенциалов. (ряд напряжений).
Ряд напряжений характеризует химические св-ва металлов. Чем более отрицателен электродный потенциал, тем выше способность металла посылать ионы в р-р, и тем сильнее проявлять себя.
Металл как восстановитель.

Потенциал электрода при нестандартных условиях
Смz+≠1
моль/л может быть рассчитан по уравнению
Нернста: Мz+/М
= °Мz+/М
+ нz+
нz+
Z – число электронов, участвующие в электродной реакции.
F – число Фарадея (F=96500 Кл/моль)
CМz+=αNМCСОЛИ
При Т=298 К
Мz+/М
= °Мz+/М
+ нz+
нz+
Водородный электрод в нестандартных условиях
Н2-2ӗ→2Н+
Н2
= °Н2
+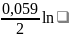 (СН+2/РН2)=0,059
lgСН+
(СН+2/РН2)=0,059
lgСН+
РН2 =1 – потенциал давления
Н2 = -0,059 рН – потенциал водородного электрода в нестандартных условиях
рН<7
2H++2ӗ→H2
Pt, Н2/H+
pH≥7
2H2O+2ӗ→2OH-+H2 – р. На электроде
Pt, H2/OH-,H2O – запись электрода
Кислородный электрод
Относится к газовым электродам (как и водородный). Представляет собой кислород, растворенный в кислой, нейтральной или щелочной среде, в которой находится металлический проводник, например платина.
О2 =1,23-0,059рН
Процесс на электродах
рН<7 O2+4ӗ+4H+D2H2O, среда кислая; схема электрода: Pt,O2/H+
рН≥7 O2+4ӗ+2H2OD4OH, среда нейтральная или щелочная, схема электрода: Pt,O2/OH,H2O
Контрольная карточка:
1)Для электрода, сведения о котором приведены в таблице, определите указанный параметр. Составьте схему электрода и схему ДЭС на нем. Напишите ур-ие равновесия на электроде (Т=298К)
Ме электрода |
°, В |
Z |
, В |
Электролит |
||
Состав |
С, моль/л |
α, % |
||||
La |
? |
? |
-2,552 |
La(NO3)3 |
0,03 |
90 |
1.Схема электрода: La/La(NO3)3
2.Схема ДЭС:

3.Уравнение равновесия на электроде: La-3ӗDLa3+ ; Z=3;
4.Уравнение
Нернста:
![]()
CLa3+=αNLa3+CСОЛИ=0,9*1*0,03=0,027 моль/л
°La3+= -2,552-0,059/3*lg0,027= -2,52 В
2)На каком из металлов Cu, Sb, Sn будет выделиться водород если пластину из металла опустить в одномолярный р-р HCl при T=298К. Реакцию выделения H2 на выбранном металле напишите в мол. и ион.мол. виде.
Металл |
Cu2+/Cu |
Sb3+/Sb |
Sn2+/Sn |
°, В |
+0,34 |
+0,2 |
-0,14 |
Будет выделяться на олове, т.к. °H2>°Sn2+/Sn
2HCl+Sn→SnCl2
2H++Sn→Sn2++H2
Контрольная карточка: 1)
Ме электрода |
°, В |
Z |
, В |
Электролит |
||
состав |
С, моль/л |
α, % |
||||
Pt,H2/H+ |
0 |
? |
-0,05 |
HCl |
? |
70 |
1.Схема электрода: Pt, H2/HCl
2).Схема ДЭС: пропускаем для газовых
2. Уравнения равновесия
H2-2ӗ→2H+ ; Z=2
3. H2=-0,059 pH
pH=-H2/0,059=0,85
CH+=0,142 моль/л
HCl=H++Cl-
CH+=αNH++CКИСЛОТЫ
CКИСЛОТЫ = 0,142/0,7*1=0,2 моль/л
2) На каком из металлов Ag, Pt, Pb будет осаждаться медь из одномолярного р-ра CuSO4, Т=298К, если пластину из поместить в р-р.
Металл |
Ag+/Ag |
Pt2+/Pt |
Pb2+/Pb |
Cu2+/Cu |
°, В |
+0,8 |
+1,2 |
-0,13 |
+0,34 |
Для этого нужен более активный – свинец
CuSO4+Pb→Cu+PbSO4
Cu2++Pb→Cu+Pb2+
Задача:
Составлены два электрода. Первый: медь погружена в р-р соли Cu2+, °=+0,337 В. Второй: медь погружена в р-р соли Cu+, °=+0,521 В.
I Cu-Cu2+ °=+0,337 В
II Cu-Cu+ °=+0,521 В
а)Запишите электродные процессы
I Cu-2ӗ→Cu2+
II Cu-ӗ→Cu+
б)Составьте схему электрода
I Cu/Cu2+
II Cu/Cu+
в)Составьте схему ДЭС
г)Какая степень окисления меди является более устойчивой в р-ре?
????????????????
Задача:
Водородный электрод погружен в 0,1 н муравьиной кисоты HCOOH, Кд(НСООН)=1,77*10-4. Определите потенциал электрода, составьте схему электрода.
Н2= -0,059 рН
НСООНDНСОО-+Н+
[H+]=
рН=-lg[H+]=3,38
H2=-0,14 В
Pt,H2/HCOOH
Задача:???????????????????????????
Гальванический элемент
Один электрод образует полуэлемент. Из двух полуэлементов получают гальванический элемент. Для его работы электроды соединяют друг с другом металлическим проводником, называемым внешней цепью. К внешней цепи относятся: выводы электродов..?.. и прибор для измерения ЭДС.
В гальваническом элементе (ГЭ) сами по себе равновесные электроды образуют не равновесную систему. Причиной неравновесности являются различные значения электродных потенциалов и как следствие этого разные плотности электронов в Ме, а следовательно стремление электронов переходить от одного Ме к другому по внешней цепи. Одновременно во внутренней цепи происходит перенос ионов.
