
- •Молекулярно-кинетические условия образования р-ра
- •Рассмотрим 3 основные стадии взаимодействия в-ва с рас-лем:
- •Диссоциация соединений различных классов.
- •Количественные характеристики процесса электролитической диссоциации.
- •Случай гидролиза:
- •Ионные реакции в растворах
- •Коллигативное (общее) свойство растворов
- •Понижение насыщенного пара рас-ля на рас-ом
- •Потенциал электрода
- •Элемент Даниэля-Якоби
- •Задача:
- •Kat восстановление окислителя происходит:
- •Элемент дифференциальной аэрации
- •Защита металлов от коррозии
- •Задача:
Элемент Даниэля-Якоби
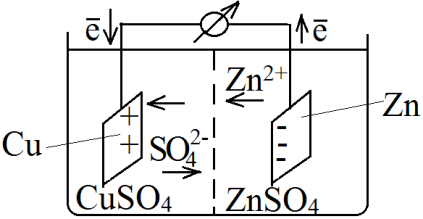
При замыкании внешней цепи самопроизвольно идут следующие процессы:
1.Цинк, элект. Потенциал которого <0, посылает в р-р большее число катионов чем медь, потенциал котрой положителен и активность очень мала, следовательно плотности электронов в цинковой пластине много выше и электроны с нее будут переходить по внешней цепи на медную.
2.Медь, получая электроны будет их отдавать своим катионам, находящимся у ее поверхности в р-ре, т е. металлическая медь будет осаждаться на электроде.
Таким образом, самопроизвольно на гальваническом электроде происходит процесс, который наз-ся окислением или растворением.
Zn-2ӗ→Zn2+
Zn – анод
На медном электроде Cu2++2ӗ→Cu – осаждение или восстановление
Cu – катод
Суммарный токообразующий процесс
А: Zn-2ӗ→Zn2+
К: Cu2++2ӗ→Cu
Zn+Cu2+→Zn2++Cu
3.В левой части освобождаются ионы SO42-, а в правой ионы Zn2+. Ионы SO42- переходят в правую часть.
Процессы будут продолжаться до тех пор, пока на катоде не высадится вся медь или не весь цинк.
Таким образом, ГЭ – это устройство в котором в результате протекания окислительно-восстановительных реакций возникает электрический ток.
Электродвижущая сила гальванического элемента (ЭДС ГЭ)
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента наз-ся ЭДС элемента.
Она равна разности равновесных потенциалов катода и анода элемента.
ЭДС обозначается Е=К-А
Расчет ЭДС
Если
ZК≠ZА,
то нужно по отдельности рассчитать К
и А,
если
ZК=ZА=Z,
то Е=°+
°=°К-°А
Как записывается гальваническая цепь.
Гальваническая цепб, элект. цепь, гал. эл – синонимы.
(А)Zn/ZnSO4//CuSO4/Cu(K)
А: Zn-2ӗ=Zn2+
K: Cu2++2ӗ→Cu
Zn+Cu2+→Zn2++Cu
(A)Fe/Fe2+//H+/Pt,H2(K)
(A) Pt,H2/NaOH//H2O/Pt,O2(K)
Чтобы вычислить ЭДС ГЭ и ответить на вопрос, будет ли она работать, нужно:
1.Расчитать потенциалы электродов. Электрод с более высоким потенциалом – катод, другой – анод.
2.Рассчитать ЭДС (она должна быть больше 0)
3.Составить схему цепи электродной реакции токообразующую реакацию.????
Связь химической или электрической работы
Если на электродах превращается один моль эквивалентов в-ва, то по закону Фарадея через систему протекает один Фарадей электричества или 96500 Кл, т.е. заряд одного моль электронов. При превращении одного моль в-ва электричество протекает в Z раз больше, т. е. Z Фарадеев электричества.
Электрическая работа равна произведению разности потенциалов на кол-во электричества и при превращении одного моль в-ва в ГЭ равна W=ZFE
С
другой стороны, максимальная полезная
работа, которую может совершить система
при протекании реакции при р=const
равна изменению энергии гипса W=
-G,
тогда это ур-ие
 - ур-ие связи химической и электрической
энергии.
- ур-ие связи химической и электрической
энергии.
Из этого ур-ия следует, что процесс самопроизвольно идет в прямом направлении если ЭДС>0 (Е>0), если Е<0, то в обратном.
Задача:
1.Анод образованпогружением никиелевой пластины в р-р с С(Ni2+)=10-4 M, T=298 K, °(Ni2+/Ni)=-0,25 В
а)Подберите к аноду катод
Pb2+/Pb(°= -0,13 B), Cr2+/Cr(°= -0,913 B), Zn2+/Zn(°= -0,76 B)
б)Составьте схему ГЭ-та из этих электродов
в)Напишите ур-ие электродного и токообразующего процессов в полученном ГЭ-те.
г)Рассчитайте ЭДС ГЭ-та.
Потенциал
рассчитывается по ур-ию Нернста
 =
=
 +
+ =
-0,25+
=
-0,25+ = -0,368 B
= -0,368 B
a)K>A
Pb – катод
б)А: Ni-2ӗ→Ni2+
K: Pb2++2ӗ→Pb
Ni+Pb2+→Ni2++Pb
г) Е=к-а= -0,13+0,368=0,238 В
2.Т=298К
Mn/Mn2+(1 M), °(Mn2+/Mn)= -1,18 B
Tl/Tl+(10-2 M), °(Tl+/Tl)= -0,37 B
 =
=
 +
+ =
-0,37+
=
-0,37+ = -0,488 B
= -0,488 B
Определите какой является анодом, а какой катодом.
а)Mn – анод; Tl - катод
б)Составьте схему ГЭ-та из этих электродов
(А)Mn/Mn2+(1 M)//Tl+(10-2M)/Tl(K)
в)А: Mn-2ӗ→Mn2+
K: Tl++ӗ→Tl /*2
Mn+2Tl+→Mn2++2Tl
г)Рассчитайте ЭДС ГЭ-та
Е=к-а= -0,488+1,18=0,692 В
Задача:
Вычислите ЭДС Г-та, составленного из водородного электрода в р-ре HCl c концентрацией 0,1 моль/л и электрода из меди в 0,01 М р-р CuSO4. Напишите схему…..
HCl, C=0,1 моль/л
СH+=NH+*α*Cк-ты=0,1 моль/л
pH=-lgCH+=1
 =
-0,059*1=0?059 B
=
-0,059*1=0?059 B
 =
=
 +
+ =
-0,34+
=
-0,34+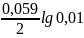 = 0,281 B
= 0,281 B
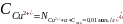
Е=к-а= -0,281+0,059=0,34 В
(А)Pt, H2/HCl(0,1 M)//CuSO4(0,01 M)/Cu(K)
А: H2-2ӗ→2H+
K: Cu2++2ӗ→Cu
Cu2++H2→Cu+2H+
Концентрационный эл-т
Состоит из 2-х одинаковых электродов, опущенных в р-ры одного и того же электролита, но разных концентраций.
Источником эл. тока в таком эл-те служит работа переноса электролита из более концентрированного р-ра в более разбавленный.
(А) Ag/Ag+(Ca)//Ag+(Ck)/Ag(K)

Е>0 Cк>Cа
Реакции на электродах:
А: Ag-ӗ→Ag+
K: Ag++ӗ→Ag
Ag+Ag+→ Ag++ Ag
Задача:
Г-ая цепь составлена магниевыми электролитами, погруженными в 0,001 н и 2М р-ры сульфата магния. Вычислите ЭДС цепи, напишите схему и электродные процессы.


(А) Mg/MgSO4(0,0005 M)//MgSO4(2 M)/Mg(K)
А: Mg-2ӗ→Mg2+
K: Mg2++2ӗ→Mg
Mg+Mg2+→ Mg2++ Mg
Коррозия металлов
Коррозия – разрушение металлов в результате их физикохимического взаимодействия с окружающей средой.
Ржавеет только железо, остальные металлы кородируют.
Коррозия – самопроизвольный процесс, протекает с уменьшением энергии Гипса.
Химическая энергия реакции коррозионного разрушения металлов выделяется в виде теплоты и рассеивается в окружающей среде.
Типы коррозии
Зависят от характера внешней среды с которой взаимодействуют металлы.
Различают химическую и электрохимическую
Химическая коррозия:
Характерна для сред, не проводящих электрический ток.
Сущность коррозии этого типа сводится к прямой окислительно-восстановительной реакции, проходящей между металлом и окислителем окружающей среды.
По условиям протекания эту коррозию различают на:
1.Газовую
Окислитель – сухие газы (обычно при высоких температурах)(образование окалины в среде кисл)
2.Разрушение стали в атмосфере водорода
3.Разрушение металлов при взаимоотношении с агрессивными газами.
Коррозия в р-рах не электролитов
Таким образом, химическая коррозия – это прямое гетерогенное взаимодействие металла с окислителем.
Электрохимическая коррозия:
При этом типе коррозии процесс взаимодействия металла с окислителем добавлением в отличии от химической коррозии пространственно разделена, а именно на одном участке происходит анодное растворение металла, на другом катодное восстановление окислителей. ????????????????
При этом возникает перемещение электронов с анодного участка на катодный, т.е. образуются коррозионные токи.
Расстояние между этими участниками не велико.
Электрохимическая коррозия характерна для сред, имеющих ионную проводимость, она может протекать в:
1.в р-рах электролитов, это практически все водные среды, и природные и искусственные ???
2.в атмосфере любого влажного газа
3.в почве
Для чего нужна токопроводящая среда?
1.Прежде всего для прохождения электродных процессов.
Поскольку электродный потенциал имеет место только в р-ре или влажной среде, кор-ия не возникает, пока металл остается сухим
2.Часть ионов среды принимает участие в электродных процессах.
Не участвующие в этих процессах ионы среды, способствуют передаче электронов, т.е. делают среду более токообразующей.
Механизмы электрохимической коррозии
Коррозия металла в средах, имеющих ионную проводимость протекает через анодное окисление металла. А: Me-Zӗ→MeZ+ и катодное восстановление окислителя К:Ох+Zӗ→Red
Окислителем в окружающей среде яв-ся кислород; а если среда влажная – H+
Ox=O2 и H+
Коррозия с участием кислорода как окислитель наз-ся коррозией с кислородной деполяризацией.
Кислородная деполяризация:
А: Me-Zӗ→MeZ+
pH≥7
K: O2+2H2O+4ӗ→4OH-
pH<7
K: O2+4H++4ӗ→2H2O
Коррозия с участием катионов водорода как окислителя наз-ся коррозией с водородной деполяризацией
Водородная деполяризация:
А: Me-Zӗ→MeZ+
pH≥7
K: 2H2O+2ӗ→Н2↑+2OH-
pH<7
K: 2H++2ӗ→H2↑
