
- •Химическое отделение вятский государственный гуманитарный университет
- •М. А. Зайцев основы биохимии
- •Часть 2
- •6. Нуклеиновые кислоты
- •6.1. Химический состав нуклеиновых кислот
- •6.2. Молекулярная масса нуклеиновых кислот
- •6.3. Локализация в клетке днк и рнк. Виды днк и рнк
- •6.4. Строение структурных элементов нуклеиновых кислот
- •6.5.1. Первичная структура днк
- •Генетический код
- •6.5.2. Вторичная структура днк
- •6.5.3. Третичная структура днк
- •6.5.4. Свойства днк
- •6.5.4.1. Репликация (редупликация, самоудвоение) днк
- •6.5.4.2. Транскрипция (синтез рнк)
- •6.6.1. Первичная структура рнк
- •6.6.2. Вторичная структура рнк
- •6.6.3. Третичная структура рнк
- •6.6.4. Классы рнк
- •6.6.5. Синтез белка (трансляция)
- •7. Общие понятия об обмене веществ и энергии в организме
- •7.1. Основные этапы обмена веществ
- •1 Этап. Подготовительный
- •2 Этап. Превращение строительных блоков (мономеров) в более простые соединения
- •3 Этап. Цикл Кребса (цикл ди- и трикарбоновых кислот, цтк)
- •4 Этап. Окислительная цепь ферментов (дыхательная цепь)
- •7.2. Обмен энергии. Макроэргические соединения
- •8. Биологическое окисление
- •8.1. Функции биологического окисления
- •8.2. Типы биологического окисления
- •II. Окисление, сопряженное с фосфорилированием адф
- •6 Железосерных белков
- •9. Обмен углеводов
- •9.1. Переваривание и всасывание углеводов
- •9.2. Синтез гликогена
- •9.3. Распад гликогена и освобождение глюкозы (глюкогенез)
- •9.4. Превращения моносахаридов
- •9.4.1. Дихотомический путь распада глюкозы. Гликолиз
- •1. Фосфорилирование:
- •9.4.2. Обмен пировиноградной кислоты
- •9.4.3. Цикл три- и дикарбоновых кислот (цикл Кребса)
- •9.4.4. Энергетический эффект гликолитического расщепления 1 молекулы глюкозы и последующего окисления пвк до со2 и н2о
- •9.4.5. Апотомический путь распада глюкозо-6-фосфата (пентозный, или пентозофосфатный цикл окисления углеводов)
- •9.5. Общая схема распада углеводов
- •9.6. Синтез углеводов
- •10. Обмен белков
- •10.1. Переваривание белков
- •10.2. Превращения аминокислот в организме
- •10.2.1. Процессы гниения белков в кишечнике
- •10.2.2. Судьба всосавшихся аминокислот
- •10.2.3. Конечные продукты распада аминокислот
- •10.3. Новообразование аминокислот
- •11. Обмен липидов
- •11.1. Переваривание и всасывание липидов
- •11.2. Окисление жирных кислот
- •11.3. Распад глицерина
- •11.4. Биосинтез липидов
- •11.4.1. Синтез высших жирных кислот
- •11.4.2. Биосинтез триглицеридов
- •12. Взаимосвязь процессов обмена веществ
- •12.1. Взаимосвязь обменов нуклеиновых кислот и белков
- •12.2. Взаимосвязь обменов нуклеиновых кислот и углеводов
- •12.3. Взаимосвязь обмена белков и углеводов
- •12.4. Взаимосвязь обмена белков и липидов
- •12.5. Взаимосвязь обмена углеводов и липидов
- •13. Регуляция обмена веществ
- •I. Метаболитный уровень регуляции
- •II. Оперонный уровень регуляции
- •III. Клеточный уровень регуляции
- •IV. Организменный уровень регуляции
- •V. Уровень регуляции метаболизма в экосистемах (популяционный)
10. Обмен белков
10.1. Переваривание белков
Главными источниками белков для человека являются пищевые продукты животного и растительного происхождения. Главным образом животные продукты (мясо, рыба, сыр) и только некоторые растительные продукты (горох, соя) богаты белками. Наиболее распространенные растительные пищевые продукты (хлеб, рис, макароны, гречневая крупа, пшено, орехи, картофель, капуста, морковь, свекла, яблоки, вишня и др.) содержат мало белка.
Белки пищи, за весьма редким исключением, не усваиваются организмом, если они не будут расщеплены в процессе переваривания пищи до свободных аминокислот, из которых затем в клетках организма строятся свойственные данному виду специфические белки.
Весь сложный процесс гидролиза пищевых белков, начиная от желудка и кончая тонким кишечником, «настроен» таким образом, чтобы путем последовательного действия протеолитических ферментов лишить белки пищи видовой специфичности и придать продуктам гидролиза способность всасываться в кровь через стенки кишечника (примерно 95–97% белков пищи всасываются в виде свободных аминокислот).
Таким образом, ферментативный аппарат желудочно-кишечного тракта осуществляет поэтапное, строго избирательное расщепление пептидных связей белковой молекулы:
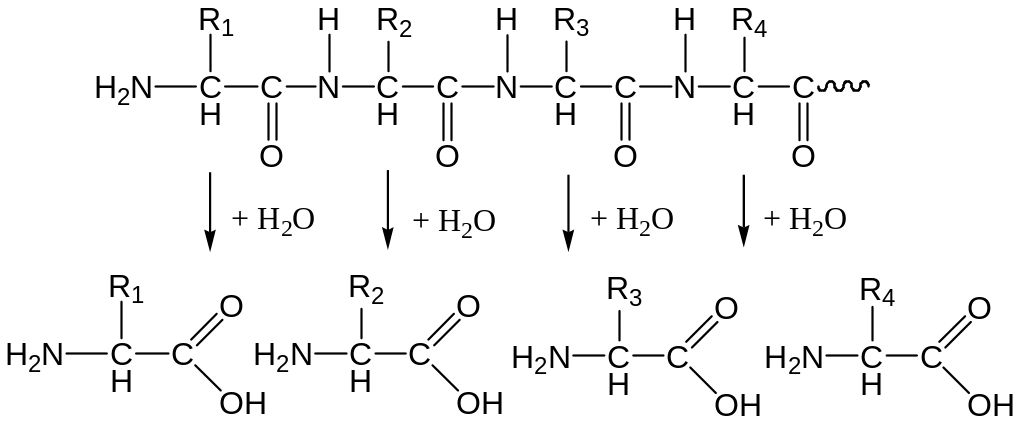
В желудке имеются все условия для переваривания белков. Во-первых, в желудочном соке содержится активный фермент пепсин. Во-вторых, благодаря наличию в желудочном соке соляной кислоты создается оптимальный для действия пепсина рН. Чистый желудочный сок имеет кислую среду (рН 0,9–1,6), а оптимум рН действия пепсина 1,5–2,5.
Соляная кислота переводит неактивный пепсиноген в активный пепсин, создает оптимальную среду для действия пепсина. В присутствии соляной кислоты происходят набухание белков (увеличение поверхности соприкосновения фермента с субстратом), частичная денатурация и, возможно, гидролиз пищевых белков.
Пепсин гидролизует преимущественно пептидные связи, образованные аминогруппами ароматических аминокислот (фен, тир). Он расщепляет практически все природные белки. В зависимости от природы белка, рН и скорости опорожнения желудка белки пищи в желудке подвергаются гидролизу пепсином с образованием полипептидов меньшего размера или коротких пептидов и, возможно, небольшого числа свободных аминокислот.
Дальнейшее превращение белков пищи осуществляется в тонком кишечнике, где на белки действуют ферменты панкреатического и кишечного соков. В поджелудочной железе вырабатываются трипсин, химотрипсин и карбоксипептидаза. Первые два фермента действуют на белки аналогично пепсину, но в отличие от него трипсин разрывает пептидные связи, образованные карбоксильными группами лиз и арг, а химотрипсин – карбоксильными группами ароматических аминокислот (фен, тир, три). Кроме того, они активны в слабощелочной среде (оптимум рН 7,2–7,8). Благодаря гидролитическому действию пепсина, трипсина и химотрипсина на белки образуются различной длины пептиды и некоторое количество свободных аминокислот.
Дальнейший гидролиз осуществляется под действием панкреатической карбоксипептидазы, кишечной аминопептидазы и различных дипептидаз. Точкой приложения аминопептидаз является пептидная связь с N-конца пептида. Карбоксипептидаза разрывает пептидную связь с С-конца пептида. Эти ферменты отщепляют по одной аминокислоте от полипептида, и, в конечном счете, остаются дипептиды, на которые действуют специфические дипептидазы, гидролизующие до свободных аминокислот.
Аминокислоты затем подвергаются всасыванию клетками кишечника.
