
- •Введение
- •1. Основы химической термодинамики
- •1.1. Основные понятия и определения термодинамики
- •1.2. I закон термодинамики
- •1.3. Внутренняя энергия как термодинамическая функция состояния системы
- •1.4. Применение I закона термодинамики к анализу некоторых термодинамических процессов
- •1.5. Теплоемкость
- •1.6. Термохимия
- •1.6.1. Влияние температуры на тепловые эффекты химических реакций и других процессов
- •1.7. II закон термодинамики
- •1.7.1. Математическое выражение II закона термодинамики
- •1.7.2. Энтропия и направление самопроизвольного протекания процессов в изолированных системах
- •1.7.3. Расчет энтропии для различных термодинамических систем и процессов
- •1.8. Взаимосвязь энтропии и термодинамической вероятности
- •1.9. Термодинамические потенциалы и направление самопроизвольных процессов. Условие термодинамического равновесия в системе
- •Взаимосвязь энергии гельмгольца с другими термодинамическими функциями и параметрами состояния системы
- •Взаимосвязь энергии гиббса с другими термодинамическими функциями и параметрами состояния системы
- •1.9. Третий закон термодинамики
- •2. Химическое равновесие
- •2.1. Понятие о химическом потенциале
- •2.2. Химический потенциал индивидуального вещества и компонента раствора
- •1. Идеальные системы
- •2. Реальные системы
- •2.3. Способы выбора стандартного состояния
- •2.4. Условие химического равновесиЯ
- •2.5. Константы химического равновесия. Закон действующих масс
- •2.6. Уравнение изотермы химической реакции. Химическое сродство
- •2.7. Влияние температуры на константу химического равновесия (уравнения изобары и изохоры химической реакции)
- •2.8. Влияние давления на константу химического равновесия (уравнение планка)
- •2.9. Энтропийный метод расчета константы химического равновесия
- •3. Термодинамика растворов и гетерогенные (фазовые) равновесия
- •3.1. Основные понятия и определения
- •3.2. Условие термодинамического равновесия в гомогенных растворах
- •3.2.1. Термодинамика идеальных растворов
- •3.2.2. Термодинамика реальных растворов
- •3.3. Равновесие в гетерогенных системах.
- •3.3.1. Теорема равновесия гиббса
- •3.3.2. Правило фаз гиббса
- •3.3.3. Применение правила фаз гиббса к анализу структуры диаграмм состояния гетерогенных систем
- •3.3.4. Уравнение состояния однокомпонентной двухфазной системы (уравнение кЛаузиуса – клапейрона)
- •3.3.5. Примеры гетерогенных (фазовых) равновесий а. Фазовое равновесие жидкость – пар
- •Растворимость газов в жидкостях (закон генри)
- •Б. Фазовое равновесие жидкость – жидкость диаграммы взаимной растворимости жидкостей в ТройныХ системАх
- •Основные типы диаграмм взаимной растворимости тройных систем
- •Распределение вещества между двумя соприкасающимися, но несмешивающимися растворителями (Закон распределения Нернста)
- •Экстракция
- •В. Фазовое равновесие жидкость – твердое вещество растворимость твердых веществ в жидкостях (закон шредера)
- •3.3.6. Коллигативные свойства растворов
- •Понижение давления пара над раствором по сравнению с чистым растворителем
- •Повышение температуры кипения и понижение температуры замерзания растворов
- •Определение молекулярной массы раствореного вещества
- •Г рафическое определение Tк и Tз
- •Осмотическое давление. Методы разделения жидких смесей мембранными методами
- •4. Электрохимия
- •4.1. Термодинамика растворов сильных электролитов
- •4.2. Электростатическая теория растворов сильных электролитов
- •4.3. Равновесие в растворах слабых электролитов
- •4.4. Электропроводность растворов электролитов.
- •4.5. Зависимость молярНой электропроводностИ электролитов от их концентрации в растворе
- •4.6. Электродвижущие силы и электродные потенциалы
- •4.6.1. Механизм возникновения электродных потенциаЛов. Уравнение нернста
- •4.6.2. Гальванические элементы
- •4.9.3. Основные типы электродов и расчет их потенциала
- •4.9.5. Потенциометрия
- •5. Химическая кинетика и катализ
- •5.1. Основные понятия и определения
- •5.2. Основной закон химической кинетики. Молекулярность и порядок реакции
- •Основы формальной кинетики.
- •5.3. Кинетика необратимых реакций
- •5.4. Методы определения порядка реакции
- •5.5. Влияние температуры на скорость реакции
- •5.6. Основные понятия катализа
- •5.6.1. Гомогенный катализ
- •5.6.2. Гетерогенный катализ
1.5. Теплоемкость
Теплоемкость – это количество теплоты, которое необходимо сообщить системе для увеличения ее температуры на 1 (К) при отсутствии полезной работы и постоянстве соответствующих параметров.
Если в качестве
системы мы берем индивидуальное вещество,
то общая теплоемкость системы
![]() равняется теплоемкости 1 моль вещества
(
равняется теплоемкости 1 моль вещества
(![]() )
умноженное на число моль (
).
)
умноженное на число моль (
).
![]() .
(16 )
.
(16 )
Теплоемкость может быть удельная и молярная.
Удельная
теплоемкость
![]() – это количество теплоты, необходимое
для нагревания единицы массы вещества
на 1 град (интенсивная величина).
– это количество теплоты, необходимое
для нагревания единицы массы вещества
на 1 град (интенсивная величина).
Молярная
теплоемкость
![]() – это количество теплоты, необходимое
для нагревания одного моль вещества на
1 град.
– это количество теплоты, необходимое
для нагревания одного моль вещества на
1 град.
Различают истинную и среднюю теплоемкость.
В технике обычно используют понятие средней теплоемкости.
Средняя
![]() – это теплоемкость для определенного
интервала температур.
– это теплоемкость для определенного
интервала температур.
Если системе,
содержащей количество вещества
или массой
![]() ,
сообщили количество теплоты
,
сообщили количество теплоты
![]() ,
а температура системы повысилась от
,
а температура системы повысилась от
![]() до
до
![]() ,
то можно рассчитать среднюю удельную
или молярную теплоемкость:
,
то можно рассчитать среднюю удельную
или молярную теплоемкость:
![]() ,
,
![]() .
(17)
.
(17)
![]() ,
,
![]() .
(18)
.
(18)
Истинная
молярная теплоемкость
![]() – это отношение бесконечно малого
количества теплоты, сообщенной 1 моль
вещества при определенной температуре,
к приращению температуры, которое при
этом наблюдается.
– это отношение бесконечно малого
количества теплоты, сообщенной 1 моль
вещества при определенной температуре,
к приращению температуры, которое при
этом наблюдается.
![]() .
(19)
.
(19)
Согласно уравнению (19), теплоемкость, как и теплота, не является функцией состояния. При постоянном давлении или объеме, согласно уравнениям (11) и (12), теплота, а, следовательно, и теплоемкость приобретают свойства функции состояния, то есть становятся характеристическими функциями системы. Таким образом, получаем изохорную и изобарную теплоемкости.
Изохорная
теплоемкость
![]() – количество теплоты, которое необходимо
сообщить системе, чтобы повысить
температуру на 1
,
если процесс происходит при
.
– количество теплоты, которое необходимо
сообщить системе, чтобы повысить
температуру на 1
,
если процесс происходит при
.
![]() .
(20)
.
(20)
Изобарная
теплоемкость
![]() – количество теплоты, которое необходимо
сообщить системе, чтобы повысить
температуру на 1
при
– количество теплоты, которое необходимо
сообщить системе, чтобы повысить
температуру на 1
при
![]() .
.
![]() .
(21)
.
(21)
Теплоемкость зависит не только от температуры, но и от объема системы, поскольку между частицами существуют силы взаимодействия, которые изменяются при изменении расстояния между ними, поэтому в уравнениях (20) и (21) используют частные производные.
Энтальпия идеального газа, как и его внутренняя энергия, является функцией только температуры:
![]() ,
,
а в соответствии
с уравнением Менделеева–Клапейрона
![]() ,
тогда
,
тогда
![]() .
(22)
.
(22)
Поэтому для идеального газа в уравнениях (20), (21) частные производные можно заменить на полные дифференциалы:
![]() .
(23)
.
(23)
![]() .
(24)
.
(24)
Из совместного
решения уравнений (23) и (24) с учетом (22),
получим уравнение взаимосвязи между
![]() и
для идеального газа.
и
для идеального газа.
![]() .
(25)
.
(25)
Разделив переменные в уравнениях (23) и (24), можно рассчитать изменение внутренней энергии и энтальпии при нагревании 1 моль идеального газа от температуры до
 .
(26)
.
(26)
 .
(27)
.
(27)
Если в указанном интервале температур теплоемкость можно считать постоянной, то в результате интегрирования получаем:
![]() .
(28)
.
(28)
![]() .
(29)
.
(29)
Установим взаимосвязь между средней и истинной теплоемкостью. Изменение энтропии с одной стороны выражается уравнением (27), с другой –
![]() .
.
Приравняв правые части уравнений и выразив среднюю теплоемкость, имеем:
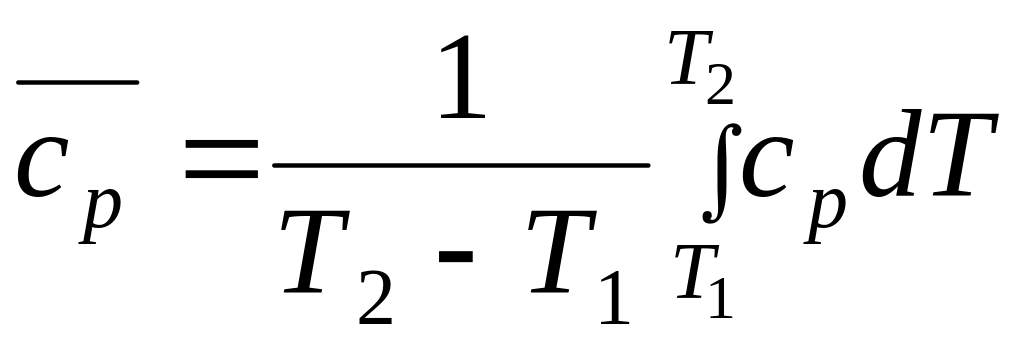 .
(30)
.
(30)
Аналогичное выражение можно получить для средней изохорной теплоемкости.
Теплоемкость большинства твердых, жидких и газообразных веществ повышается с ростом температуры. Зависимость теплоемкости твердых, жидких и газообразных веществ от температуры выражается эмпирическим уравнением вида:
![]() .
(31)
.
(31)
где а, b,
c и
![]() – эмпирические коэффициенты, вычисленные
на основе экспериментальных данных о
– эмпирические коэффициенты, вычисленные
на основе экспериментальных данных о
![]() ,
причем коэффициент
относится к органическим веществам, а
,
причем коэффициент
относится к органическим веществам, а
![]() – к неорганическим. Значения коэффициентов
для различных веществ приведены в
справочнике и применимы только для
указанного интервала температур.
– к неорганическим. Значения коэффициентов
для различных веществ приведены в
справочнике и применимы только для
указанного интервала температур.
Теплоемкость
идеального газа не зависит от температуры.
Согласно молекулярно-кинетической
теории теплоемкость, приходящаяся на
одну степень свободы, равна
![]() (степень свободы – число независимых
видов движения на которые можно разложить
сложное движение молекулы). Для одноатомной
молекулы характерно поступательное
движение, которое можно разложить на
три составляющие в соответствии с тремя
взаимно перпендикулярными направлениями
по трем осям. Поэтому изохорная
теплоемкость одноатомного идеального
газа равна
(степень свободы – число независимых
видов движения на которые можно разложить
сложное движение молекулы). Для одноатомной
молекулы характерно поступательное
движение, которое можно разложить на
три составляющие в соответствии с тремя
взаимно перпендикулярными направлениями
по трем осям. Поэтому изохорная
теплоемкость одноатомного идеального
газа равна
![]() .
(32)
.
(32)
Тогда изобарная теплоемкость одноатомного идеального газа согласно (25) определится по уравнению
![]() .
(33)
.
(33)
Двухатомные молекулы идеального газа помимо трех степеней свободы поступательного движения имеют и 2 степени свободы вращательного движения. Следовательно:
![]() ,
,
![]() .
.
