
- •Введение
- •1. Основы химической термодинамики
- •1.1. Основные понятия и определения термодинамики
- •1.2. I закон термодинамики
- •1.3. Внутренняя энергия как термодинамическая функция состояния системы
- •1.4. Применение I закона термодинамики к анализу некоторых термодинамических процессов
- •1.5. Теплоемкость
- •1.6. Термохимия
- •1.6.1. Влияние температуры на тепловые эффекты химических реакций и других процессов
- •1.7. II закон термодинамики
- •1.7.1. Математическое выражение II закона термодинамики
- •1.7.2. Энтропия и направление самопроизвольного протекания процессов в изолированных системах
- •1.7.3. Расчет энтропии для различных термодинамических систем и процессов
- •1.8. Взаимосвязь энтропии и термодинамической вероятности
- •1.9. Термодинамические потенциалы и направление самопроизвольных процессов. Условие термодинамического равновесия в системе
- •Взаимосвязь энергии гельмгольца с другими термодинамическими функциями и параметрами состояния системы
- •Взаимосвязь энергии гиббса с другими термодинамическими функциями и параметрами состояния системы
- •1.9. Третий закон термодинамики
- •2. Химическое равновесие
- •2.1. Понятие о химическом потенциале
- •2.2. Химический потенциал индивидуального вещества и компонента раствора
- •1. Идеальные системы
- •2. Реальные системы
- •2.3. Способы выбора стандартного состояния
- •2.4. Условие химического равновесиЯ
- •2.5. Константы химического равновесия. Закон действующих масс
- •2.6. Уравнение изотермы химической реакции. Химическое сродство
- •2.7. Влияние температуры на константу химического равновесия (уравнения изобары и изохоры химической реакции)
- •2.8. Влияние давления на константу химического равновесия (уравнение планка)
- •2.9. Энтропийный метод расчета константы химического равновесия
- •3. Термодинамика растворов и гетерогенные (фазовые) равновесия
- •3.1. Основные понятия и определения
- •3.2. Условие термодинамического равновесия в гомогенных растворах
- •3.2.1. Термодинамика идеальных растворов
- •3.2.2. Термодинамика реальных растворов
- •3.3. Равновесие в гетерогенных системах.
- •3.3.1. Теорема равновесия гиббса
- •3.3.2. Правило фаз гиббса
- •3.3.3. Применение правила фаз гиббса к анализу структуры диаграмм состояния гетерогенных систем
- •3.3.4. Уравнение состояния однокомпонентной двухфазной системы (уравнение кЛаузиуса – клапейрона)
- •3.3.5. Примеры гетерогенных (фазовых) равновесий а. Фазовое равновесие жидкость – пар
- •Растворимость газов в жидкостях (закон генри)
- •Б. Фазовое равновесие жидкость – жидкость диаграммы взаимной растворимости жидкостей в ТройныХ системАх
- •Основные типы диаграмм взаимной растворимости тройных систем
- •Распределение вещества между двумя соприкасающимися, но несмешивающимися растворителями (Закон распределения Нернста)
- •Экстракция
- •В. Фазовое равновесие жидкость – твердое вещество растворимость твердых веществ в жидкостях (закон шредера)
- •3.3.6. Коллигативные свойства растворов
- •Понижение давления пара над раствором по сравнению с чистым растворителем
- •Повышение температуры кипения и понижение температуры замерзания растворов
- •Определение молекулярной массы раствореного вещества
- •Г рафическое определение Tк и Tз
- •Осмотическое давление. Методы разделения жидких смесей мембранными методами
- •4. Электрохимия
- •4.1. Термодинамика растворов сильных электролитов
- •4.2. Электростатическая теория растворов сильных электролитов
- •4.3. Равновесие в растворах слабых электролитов
- •4.4. Электропроводность растворов электролитов.
- •4.5. Зависимость молярНой электропроводностИ электролитов от их концентрации в растворе
- •4.6. Электродвижущие силы и электродные потенциалы
- •4.6.1. Механизм возникновения электродных потенциаЛов. Уравнение нернста
- •4.6.2. Гальванические элементы
- •4.9.3. Основные типы электродов и расчет их потенциала
- •4.9.5. Потенциометрия
- •5. Химическая кинетика и катализ
- •5.1. Основные понятия и определения
- •5.2. Основной закон химической кинетики. Молекулярность и порядок реакции
- •Основы формальной кинетики.
- •5.3. Кинетика необратимых реакций
- •5.4. Методы определения порядка реакции
- •5.5. Влияние температуры на скорость реакции
- •5.6. Основные понятия катализа
- •5.6.1. Гомогенный катализ
- •5.6.2. Гетерогенный катализ
Взаимосвязь энергии гельмгольца с другими термодинамическими функциями и параметрами состояния системы
1) продифференцируем уравнение (76):
![]() .
.
Подставим в
полученное уравнение вместо
![]() его значение из уравнения (71), получим:
его значение из уравнения (71), получим:
![]() ;
;
![]() .
.
Поскольку
изменяется при изменении объема и
температуры, то есть
![]() ,
то
и
называют собственными параметрами
состояния системы для свободной энергии
Гельмгольца.
,
то
и
называют собственными параметрами
состояния системы для свободной энергии
Гельмгольца.
Если
:
![]() уравнение устанавливает связь
с
;
уравнение устанавливает связь
с
;
:
![]() уравнение устанавливает связь
с
.
уравнение устанавливает связь
с
.
Функцию, производная которой выражает другую термодинамическую функцию или параметр состояния, называют характеристической функцией.
Таким образом, свободная энергия Гельмгольца является характеристической функцией.
2) применим теперь уравнение (76) к начальному (1) и конечному (2) состояниям системы в каком-либо изохорно-изотермическом процессе:
![]() ;
;
![]() .
.
Вычтем почленно, получим:
![]() (78) уравнение
Гиббса – Гельмгольца, позволяющее
определить возможность протекания
изохорно-изотермического процесса
(78) уравнение
Гиббса – Гельмгольца, позволяющее
определить возможность протекания
изохорно-изотермического процесса
Перепишем уравнение Гиббса – Гельмгольца (78) в виде:
![]() ,
,
подставим вместо
![]() ,
,
![]() и
и
![]() их значения:
их значения:
![]() ;
;
![]() ;
;
![]() .
.
После подстановки, получим:
![]() (79) уравнение
максимальной работы Гиббса – Гельмгольца
(79) уравнение
максимальной работы Гиббса – Гельмгольца
В уравнении (79):
![]() – тепловой эффект изохорно-изотермического
процесса – и
– легко рассчитываются.
– тепловой эффект изохорно-изотермического
процесса – и
– легко рассчитываются.
Следовательно, подставляя их значения в уравнение можно определить идет реакция или нет. Максимально возможный выход будет при равновесии.
Когда
![]()
![]()
![]() прямой ход реакции;
прямой ход реакции;
![]()
![]()
![]() обратный ход
реакции;
обратный ход
реакции;
![]()
![]()
![]() термодинамическое
равновесие.
термодинамическое
равновесие.
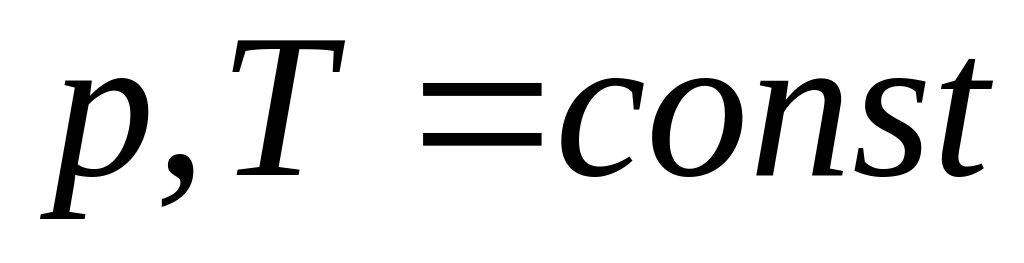 (изобарно-изотермический
процесс) (их большинство)
(изобарно-изотермический
процесс) (их большинство)
Для анализа воспользуемся выражением (74), получим:
![]() или
или
![]() ;
;
![]() ;
;
![]() .
(80)
.
(80)
Функция
![]() обладает всеми свойствами термодинамической
функции состояния.
– энергия Гиббса (свободная энтальпия)
– пятая термодинамическая функций
состояния.
обладает всеми свойствами термодинамической
функции состояния.
– энергия Гиббса (свободная энтальпия)
– пятая термодинамическая функций
состояния.
Получаем:
![]()
![]() .
.
Знак неравенства характеризует условие самопроизвольного (необратимого) протекания изобарно-изотермического процесса. Как видно, таким условием является убыль энергии Гиббса.
![]() (
(![]() ).
).
Равновесие в системе при изохорно-изотермических условиях устанавливается при минимальном значении энергия Гиббса. Условием минимума функции и, следовательно, равновесия является:
![]() .
.
Применим теперь к анализу обратимого изобарно-изотермического процесса уравнение (71), получим:
![]() .
.
После интегрирования имеем:
![]() .
(81)
.
(81)
Как видим, убыль энергии Гиббса в изобарно-изотермическом процессе характеризует его максимальную работу.
Таким образом, энергия Гиббса является изобарно-изотермическим термодинамическим потенциалом.
Взаимосвязь энергии гиббса с другими термодинамическими функциями и параметрами состояния системы
1) подставив в уравнение (80) значение энтальпии :
![]() ,
,
получим:
![]() .
(82)
.
(82)
Для 1 моль идеального газа , следовательно
![]() .
.
Из анализа последнего
уравнения видно, что если идеальный газ
взят при абсолютном нуле температур,
то
![]() ,
а
,
а
![]() и
одинаковы.
и
одинаковы.
2) продифференцировав уравнение (82), получим:
![]() .
.
Так как
![]() ,
,
![]() .
(83)
.
(83)
Поскольку
изменяется при изменении давления и
температуры, т.е.
![]() ,
то
и
являются собственными параметрами
состояния системы энергии Гиббса.
,
то
и
являются собственными параметрами
состояния системы энергии Гиббса.
Если
![]() :
:
![]() уравнение устанавливает связь
с
;
уравнение устанавливает связь
с
;
:
![]() уравнение устанавливает связь
с
.
уравнение устанавливает связь
с
.
Таким образом, энергия Гиббса является характеристической функцией.
3) запишем уравнение (80) последовательно для исходного (1) и конечного (2) состояния системы в каком-либо изобарно-изотермическом процессе:
![]() ;
;
![]() .
.
вычтем почленно из последнего уравнения предыдущее и получим вторую форму записи уравнения Гиббса – Гельмгольца:
![]() (84) Уравнение
Гиббса – Гельмгольца, позволяющее
определить возможность протекания
изобарно-изотер-мического процесса
(применяется чаще, чем первая)
(84) Уравнение
Гиббса – Гельмгольца, позволяющее
определить возможность протекания
изобарно-изотер-мического процесса
(применяется чаще, чем первая)
Перепишем уравнение Гиббса-Гельмгольца (83) в виде:
![]() .
.
подставим в (83)
вместо
![]() ,
,
![]() и
и
![]() их значения:
их значения:
![]() ;
;
![]() ;
;
![]() .
.
После подстановки, получим:
![]() (85) уравнение
максимальной работы Гиббса-Гельмгольца
(85) уравнение
максимальной работы Гиббса-Гельмгольца
Когда
![]()
![]() прямой ход реакции;
прямой ход реакции;
![]()
![]() обратный ход
реакции;
обратный ход
реакции;
![]()
![]() условие
термодинамического равновесия в системе
при
условие
термодинамического равновесия в системе
при
![]() .
.
Вывод: есть пять критериев направления самопроизвольного протекания процессов и равновесия в системах ( и 4 термодинамические потенциала)
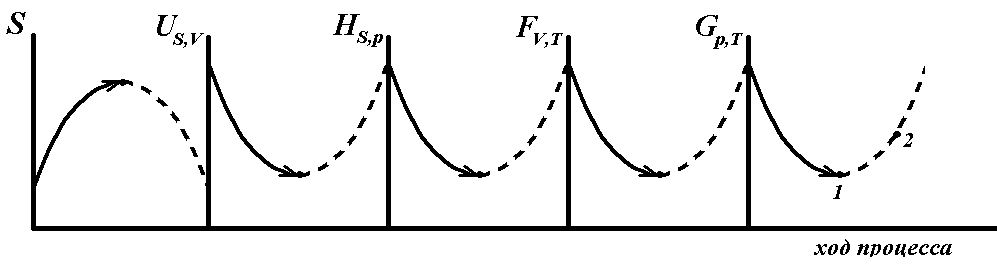
Рис.
9. Изменение энтропии
,
![]() – ,
– ,
![]() – ,
– ,
![]() – ,
– ,
![]() – потенциалов в ходе процесса:
самопроизвольный процесс; --- –
несамопроизвольный процесс
– потенциалов в ходе процесса:
самопроизвольный процесс; --- –
несамопроизвольный процесс
Система |
Условие самопроизвольного протекания процесса |
Условие равновесия |
Условие экстремума |
Изолированная |
|
|
|
Любая |
|
|
|
