
- •Химический анализ
- •Часть 1. Качественный анализ неорганических веществ
- •Введение
- •1. Качественный анализ неорганических веществ
- •1.1. Методы и условия проведения качественного химического анализа
- •Классификация методов анализа в зависимости от количества исследуемого вещества
- •Методы разделения и концентрирования
- •1.2. Качественные аналитические реакции и аналитические признаки
- •1.3. Реактивы, применяемые в качественном анализе
- •Органические реактивы, используемые в качественном анализе
- •1.4. Аналитическая классификация ионов в качественном анализе
- •Аналитическая классификация анионов
- •Контрольные вопросы
- •2. Кислотно-основная аналитическая классификация катионов
- •2.1. Первая аналитическая группа катионов
- •2.1.1. Реакции катиона лития
- •4. Реакция с гексанитрокобальтатом(III) натрия Na3[Co(no2)6]:
- •2.1.3. Реакции катиона натрия
- •2.1.4. Реакции катиона калия
- •2. Реакция с гидротартратом натрия NaHc4h4o6.
- •3. Реакция с гексанитрокобальтатом(III) натрия Na3[Co(no2)6].
- •4. Реакция с гексанитрокупратом(II) свинца и натрия Na2Pb[Cu(no2)6].
- •Сводная таблица реакций катионов первой аналитической группы
- •2.2. Вторая аналитическая группа катионов
- •2.2.1. Реакции катиона серебра
- •2.2.3. Реакции катиона свинца(II)
- •Сводная таблица реакций катионов второй аналитической группы
- •2.3. Третья аналитическая группа катионов
- •2.3.1. Реакции катиона бария
- •2.3.2. Реакции катиона кальция
- •2.3.3. Реакции катиона стронция
- •Сводная таблица реакций катионов третьей аналитической группы
- •2.4. Четвёртая аналитическая группа катионов
- •2.4.1. Реакции катиона алюминия
- •2.4.2. Реакции катиона хрома (III)
- •2.4.3. Реакции катиона цинка
- •2.4.4. Реакции катионов олова(II) и (IV)
- •Сводная таблица реакций катионов четвертой аналитической группы
- •2.5. Пятая аналитическая группа катионов
- •2.5.3. Реакции катиона марганца (II)
- •2.5.4. Реакции катиона магния
- •2.5.5. Реакции катиона висмута (III)
- •2. Реакция с 8-оксихинолином c9h6n(он).
- •2.5.6. Реакции катиона сурьмы (III)
- •1. Реакция с тиосульфатом натрия Na2s2o3.
- •2.5.7. Реакции катиона сурьмы(V)
- •Сводная таблица реакций катионов пятой аналитической группы
- •2.6. Шестая аналитическая группа катионов
- •2.6.1. Реакции катиона меди (II)
- •2.6.2. Реакции катиона никеля(II)
- •2.6.3. Реакции катиона кобальта(II)
- •2.6.5. Реакции катиона ртути(II)
- •Сводная таблица реакций катионов шестой аналитической группы
- •Контрольные вопросы к разделу 2.1
- •Контрольные вопросы к разделу 2.2
- •Контрольные вопросы к разделу 2.3
- •Контрольные вопросы к разделу 2.4
- •Контрольные вопросы к разделу 2.5
- •Контрольные вопросы к разделу 2.6
- •3. Аналитическая классификация анионов
- •3.1. Анионы первой аналитической группы
- •3.1.1. Реакции хлорид - иона
- •3.1.2. Реакции бромид-иона
- •3.1.3. Реакции иодид-иона
- •3. Реакция окисления нитритом натрия:
- •3.1.4. Реакции сульфид-иона
- •5. Реакция с гидроксокомплексом свинца [Pb(oh)4 ]2-:
- •Качественные реакции анионов первой аналитической группы
- •3.2. Анионы второй аналитической группы
- •3.2.2. Реакции сульфит-иона
- •3.2.3. Реакции карбонат-иона
- •3.2.4. Реакции фосфат-иона
- •3.2.5. Реакции тиосульфат-иона
- •3.2.6. Реакции силикат-иона
- •3.2.7. Реакции борат-иона
- •Качественные реакции анионов второй аналитической группы
- •3.3. Анионы третьей аналитической группы
- •3.3.1. Реакции нитрат-иона
- •3.3.2. Реакции нитрит-иона
- •2. Реакция с иодидом калия ki.
- •Качественные реакции анионов третьей аналитической группы
- •Контрольные вопросы к разделу 3.1
- •Контрольные вопросы к разделу 3.2
- •Контрольные вопросы к разделу 3.3
- •4. Качественный анализ неизвестного вещества
- •4.1. Предварительные испытания
- •Предварительные испытания неизвестного вещества
- •4.2. Анализ индивидуальной соли
- •4.3. Систематический анализ смеси катионов
- •4.3.2. Систематический ход анализа (один из вариантов).
- •6. Анализ раствора 4 (V группа). Аммиакат меди – синий, никеля – сине-голубой, кобальта – желтый.
- •Контрольные вопросы
- •Список литературы
- •Химический анализ
- •Часть 1. Качественный анализ неорганических веществ
2.6.2. Реакции катиона никеля(II)
Растворы солей никеля(II) имеют характерную изумрудно-зелёную окраску.
+++1. Реакция с диметилглиоксимом (реактивом Чугаева С4H8N2O2). Диметилглиоксим образует с ионами никеля (II) в интервале рН 5-10 малорастворимую в воде внутрикомплексную соль диметилглиоксимат никеля ярко-красного цвета. Мешают определению ионы Fe2+, Co2+, Cu2+, также образующие с диметилглиоксимом окрашенные соединения.
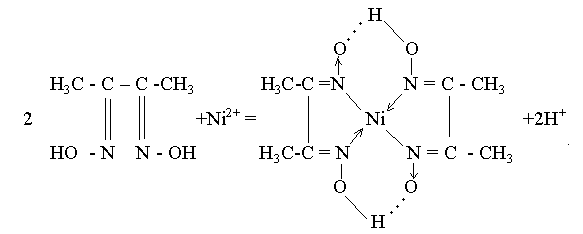
Методика проведения реакции. К 1-2 каплям раствора, содержащего ионы Ni2+, добавляют 1-2 капли 1%-ного этанольного раствора диметилглиоксима и 1-2 капли водного раствора аммиака. Образуется характерный ярко-красный осадок.
2.6.3. Реакции катиона кобальта(II)
Растворы солей кобальта (II) окрашены в розовый цвет.
+++1. Реакция с роданидом аммония NH4SCN. Растворы солей кобальта при рН=4-5 с сухой солью NH4SCN образуют неустойчивый комплекс [Co(SCN)4]2- синего цвета, хорошо экстрагирующийся изоамиловым спиртом. В органическом растворителе комплекс более устойчив.
Co2+ + 4 SCN- = [Co(SCN)4]2-.
Проведению реакции мешают ионы Cu2+, Fe3+, Bi3+. Мешающее влияние ионов Fe3+ устраняют добавлением в реакционную систему фторид-ионов.
Методика проведения реакции. К 2-3 каплям анализируемого раствора добавляют твердый роданид аммония, 5-7 капель изоамилового спирта и встряхивают. Слой изоамилового спирта окрашивается в присутствии ионов кобальта в синий цвет.
2. Реакция окисления нитритом калия КNO2. Нитрит калия в уксуснокислом растворе при рН 4-5 образует с ионами кобальта желтый осадок гексанитрокобальтата(III) калия K3[Co(NO2)6]. В разбавленных растворах осадок образуется при нагревании и стоянии.
Co2+ +7КNO2 +2CH3COOH = K3[Co(NO2)6] +NO(г) +H2O +2CH3COO-+4 К+
Методика проведения реакции. К 2-3 каплям раствора, содержащего ионы Co2+, добавляют 2 капли 2 н. CH3COOH, 2 капли CH3COONa и твердый KNO2. Смесь нагревают несколько минут на водяной бане. Образуется желтый осадок.
+++2.6.4. Реакции катиона кадмия
1. Реакция с тетраиодовисмутатом калия K[BiI4]. Ионы кадмия разрушают оранжевый комплекс K[BiI4]. В результате реакции выпадает черный осадок BiI3:
K[BiI4] = BiI3 (тв) + KI.
Методика проведения реакции. Одну каплю предварительно приготовленного раствора K[BiI4] нанести на фильтровальную бумагу, а затем в центр пятна поместить капилляр с раствором соли кадмия. Появляется черное пятно BiI3. Раствор K[BiI4] готовят, прибавляя к одной капле соли висмута раствор иодида калия до растворения первоначально выпавшего осадка.
+++2. Реакция с тиомочевиной CS(NH2)2. Тиомочевина образует с солями кадмия комплексное соединение, легко разлагающееся при действии сероводорода с выпадением желтого осадка сульфида кадмия.
CdCl2 + 4CS(NH2)2 = [Cd(CSN2H4)4]Cl2,
[Cd(CSN2H4)2]Cl2 + H2S(г) = CdS(тв) + 2HCl +4CSN2H4.
Методика проведения реакции. К 2-3 каплям раствора соли Сd2+ добавить 2-3 кристаллика тиомочевины и перемешать. Через 2-3 минуты добавить 4-5 капель сероводородной воды и наблюдать выпадение желтого осадка.
