
- •Химический анализ
- •Часть 1. Качественный анализ неорганических веществ
- •Введение
- •1. Качественный анализ неорганических веществ
- •1.1. Методы и условия проведения качественного химического анализа
- •Классификация методов анализа в зависимости от количества исследуемого вещества
- •Методы разделения и концентрирования
- •1.2. Качественные аналитические реакции и аналитические признаки
- •1.3. Реактивы, применяемые в качественном анализе
- •Органические реактивы, используемые в качественном анализе
- •1.4. Аналитическая классификация ионов в качественном анализе
- •Аналитическая классификация анионов
- •Контрольные вопросы
- •2. Кислотно-основная аналитическая классификация катионов
- •2.1. Первая аналитическая группа катионов
- •2.1.1. Реакции катиона лития
- •4. Реакция с гексанитрокобальтатом(III) натрия Na3[Co(no2)6]:
- •2.1.3. Реакции катиона натрия
- •2.1.4. Реакции катиона калия
- •2. Реакция с гидротартратом натрия NaHc4h4o6.
- •3. Реакция с гексанитрокобальтатом(III) натрия Na3[Co(no2)6].
- •4. Реакция с гексанитрокупратом(II) свинца и натрия Na2Pb[Cu(no2)6].
- •Сводная таблица реакций катионов первой аналитической группы
- •2.2. Вторая аналитическая группа катионов
- •2.2.1. Реакции катиона серебра
- •2.2.3. Реакции катиона свинца(II)
- •Сводная таблица реакций катионов второй аналитической группы
- •2.3. Третья аналитическая группа катионов
- •2.3.1. Реакции катиона бария
- •2.3.2. Реакции катиона кальция
- •2.3.3. Реакции катиона стронция
- •Сводная таблица реакций катионов третьей аналитической группы
- •2.4. Четвёртая аналитическая группа катионов
- •2.4.1. Реакции катиона алюминия
- •2.4.2. Реакции катиона хрома (III)
- •2.4.3. Реакции катиона цинка
- •2.4.4. Реакции катионов олова(II) и (IV)
- •Сводная таблица реакций катионов четвертой аналитической группы
- •2.5. Пятая аналитическая группа катионов
- •2.5.3. Реакции катиона марганца (II)
- •2.5.4. Реакции катиона магния
- •2.5.5. Реакции катиона висмута (III)
- •2. Реакция с 8-оксихинолином c9h6n(он).
- •2.5.6. Реакции катиона сурьмы (III)
- •1. Реакция с тиосульфатом натрия Na2s2o3.
- •2.5.7. Реакции катиона сурьмы(V)
- •Сводная таблица реакций катионов пятой аналитической группы
- •2.6. Шестая аналитическая группа катионов
- •2.6.1. Реакции катиона меди (II)
- •2.6.2. Реакции катиона никеля(II)
- •2.6.3. Реакции катиона кобальта(II)
- •2.6.5. Реакции катиона ртути(II)
- •Сводная таблица реакций катионов шестой аналитической группы
- •Контрольные вопросы к разделу 2.1
- •Контрольные вопросы к разделу 2.2
- •Контрольные вопросы к разделу 2.3
- •Контрольные вопросы к разделу 2.4
- •Контрольные вопросы к разделу 2.5
- •Контрольные вопросы к разделу 2.6
- •3. Аналитическая классификация анионов
- •3.1. Анионы первой аналитической группы
- •3.1.1. Реакции хлорид - иона
- •3.1.2. Реакции бромид-иона
- •3.1.3. Реакции иодид-иона
- •3. Реакция окисления нитритом натрия:
- •3.1.4. Реакции сульфид-иона
- •5. Реакция с гидроксокомплексом свинца [Pb(oh)4 ]2-:
- •Качественные реакции анионов первой аналитической группы
- •3.2. Анионы второй аналитической группы
- •3.2.2. Реакции сульфит-иона
- •3.2.3. Реакции карбонат-иона
- •3.2.4. Реакции фосфат-иона
- •3.2.5. Реакции тиосульфат-иона
- •3.2.6. Реакции силикат-иона
- •3.2.7. Реакции борат-иона
- •Качественные реакции анионов второй аналитической группы
- •3.3. Анионы третьей аналитической группы
- •3.3.1. Реакции нитрат-иона
- •3.3.2. Реакции нитрит-иона
- •2. Реакция с иодидом калия ki.
- •Качественные реакции анионов третьей аналитической группы
- •Контрольные вопросы к разделу 3.1
- •Контрольные вопросы к разделу 3.2
- •Контрольные вопросы к разделу 3.3
- •4. Качественный анализ неизвестного вещества
- •4.1. Предварительные испытания
- •Предварительные испытания неизвестного вещества
- •4.2. Анализ индивидуальной соли
- •4.3. Систематический анализ смеси катионов
- •4.3.2. Систематический ход анализа (один из вариантов).
- •6. Анализ раствора 4 (V группа). Аммиакат меди – синий, никеля – сине-голубой, кобальта – желтый.
- •Контрольные вопросы
- •Список литературы
- •Химический анализ
- •Часть 1. Качественный анализ неорганических веществ
2.6. Шестая аналитическая группа катионов
К шестой аналитической группе относятся катионы Co2+, Ni2+, Cu2+, Cd2+, Hg2+. Групповым реагентом является раствор аммиака, который осаждает катионы в виде гидроксидов или основных солей:
CoCl2 + NH4OH = CoOHCl(тв) + NH4Cl,
2CuSO4 + 2NH4OH = (CuOH)2SO4(тв) + (NH4 )2SO4,
CdCl2 + 2NH4OH = Cd(OH)2(тв) + 2NH4Cl,
NiCl2 + NH4OH = NiOHCl(тв) + NH4Cl,
HgCl2 + 2NH4OH = [HgNH2]Cl(тв) + NH4Cl + 2H2O.
Гидроксиды и основные соли взаимодействуют с избытком раствора гидроксида аммония, образуя растворимые комплексные соли:
CoOHCl (тв) + 5NH4OH + NH4Cl = [Co(NH3)6]Cl2 + H2O,
желтый
NiOHCl (тв) + 5NH4OH + NH4Cl = [Ni(NH3)6]Cl2 + 6H2O,
сине-красный
[Hg(NH2)]Cl (тв) + 2NH4OH + NH4Cl = [Hg(NH3)4]Cl2 + 2H2O,
бесцветный
Cd(OH)2(тв) + 2NH4OH + 2NH4Cl = [Cd(NH3)4]Cl2 + 4H2O,
бесцветный
(CuOH)2SO4(тв) + 2NH4OH + (NH4)2SO4 = 2[Cu(NH3)4]SO4 + 4H2O.
синий
При взаимодействии катионов шестой группы с едкими щелочами в осадки выпадают их гидроксиды, оксиды или основные соли, растворимые в кислотах и гидроксиде аммония и нерастворимые в щелочах.
2.6.1. Реакции катиона меди (II)
Растворы солей меди имеют характерную голубую окраску.
1. Окрашивание пламени. Бесцветное пламя горелки окрашивается солями меди(II) в зеленый цвет.
+++2. Реакция с раствором гидроксида аммония NH4OH. В избытке гидроксида аммония соли меди образуют аммиачный комплекс интенсивной сине-фиолетовой окраски. С помощью данной реакции можно открыть ионы Cu2+ в присутствии других катионов.
CuSO4 + 4NH4OH = [Cu(NH3)4]SO4 + 4H2O.
Методика проведения реакции. К 1-2 каплям раствора соли меди в пробирке добавляют по каплям раствор аммиака. Выпавший вначале голубой осадок гидроксида меди растворяется в избытке аммиака с образованием комплексного иона ярко-василькового цвета.
3. Реакция с тиосульфатом натрия Na2S2O3. При взаимодействии катиона Cu2+ в кислой среде при нагревании с избытком реагента образуется смешанный осадок сульфида меди(I) и серы темно-бурого цвета, растворимый в азотной кислоте:
2Cu2+ + 2S2O32- + 2H2O = Cu2S(тв) + S(тв) + 4H+ + 2SO42-.
Методика проведения реакции. К 3 каплям раствора соли меди добавляют 4 капли воды, 3 капли раствора серной кислоты, 3 кристаллика тиосульфата натрия и нагревают.
4. Реакция восстановления до металлической меди. Металлы, стоящие в ряду напряжения до меди (железо, цинк, алюминий), способны восстанавливать Cu2+ до элементарной меди.
Cu2+ + Zn(тв) = Cu(тв) + Zn2+.
Методика проведения реакции. На очищенную металлическую пластинку (алюминиевую, железную, цинковую) наносят каплю раствора меди, каплю серной кислоты и оставляют на 2-3 минуты. Наблюдают появление красного пятна металлической меди.
+++5. Реакция с гексацианоферратом(II) калия K4[Fe(CN)6].
2Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6] (тв).
Образуется красно-бурый осадок гексацианоферрата(II) меди, нерастворимый в разбавленных кислотах. В гидроксиде аммония осадок растворяется с образованием гидроксида тетрааминмеди (II):
Cu2[Fe(CN)6] + 12NH4OH = (NH4)4[Fe(CN)6] + 2[Cu(NH3)4](OH)2 + 8H2O.
Определению мешают ионы Fe3+, Ni2+, Co2+.
Методика проведения реакции. К 3 каплям раствора соли меди добавляют 3 капли раствора гексацианоферрата(II) калия. Проверяют растворимость образовавшегося осадка в гидроксиде аммония.
6. Реакция с дитизоном (С6H5)2CSN4H2. Дитизон при рН = 1-4 образует с катионом Cu2+ внутрикомплексное соединение красно-фиолетового цвета, экстрагируемое CHCl3 и CCl4. Определению мешают ионы Hg2+, Ag+. Если в качестве маскирующего реагента использовать KI при рН 1-2, то медь можно определять без помех со стороны других ионов.
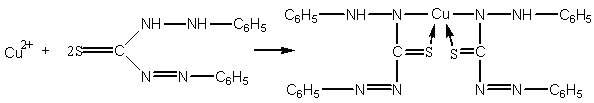
Методика проведения реакции. К 1-2 каплям анализируемого раствора с рН 1-2 прибавляют 5-6 капель 5%-ного раствора KI и экстрагируют 0,02%-ным раствором дитизона в четыреххлористом углероде. В присутствии меди органический слой окрашивается в красно-фиолетовый цвет.
