
- •Специальные разделы оптического материаловедения
- •Термодинамика фазовых равновесий
- •1.1 Общие сведения о термодинамике
- •1 Предмет термодинамики1
- •1.1.2 Термодинамическая система, виды систем
- •Изолированные системы – те, которые не имеют возможности обмениваться веществом и энергией с окружением и имеющие постоянный объем.
- •1.1.3 Параметры состояния, параметры процессов
- •1.1.4 Функции состояния
- •1.1.5 Виды процессов
- •1.1.6 Внутренняя энергия, теплота и работа
- •1.1.7 Максимальная работа при изобарических, изотермических, адиабатических и изохорных процессах
- •1.2 Законы термодинамики
- •1.2.2 II закон термодинамики и энтропия как термодинамическая функция
- •1.2.3 Энтропия и термодинамическая вероятность. III закон термодинамики
- •Следствия Законов
- •1.2.5 Термодинамические функции, важные для материаловедения.
- •1.2.6 Применение термодинамических понятий в других областях науки
- •1.3 Производные термодинамических потенциалов и фазовые переходы
- •1.3.1 Первые производные термодинамических потенциалов, их физический
- •1.3.2 Вторые производные термодинамических потенциалов (соотношения
- •1.3.3 Фазовые переходы I и II рода.
- •1.3.4 Фазовые переходы I рода. Барическая зависимость фазовых переходов I рода:
- •1.4 Теория фазовых равновесий
- •1.4.1 Понятия «фазовые равновесия», «компонент», «диаграмма состояний»,
- •1.4.2 Понятие химического потенциала. Условия равновесия фаз. Правило фаз
- •1.4.3 Диаграмма состояний однокомпонентной системы
- •1.4.5 Эвтектики (двухкомпонентные системы). Линии ликвидуса и солидуса.
- •1.4.6 Твердые растворы (двухкомпонентные системы). Значение твердых
- •1.4.7 Ограниченные твердые растворы
- •1.4.8 Упорядочение твердых растворов
- •1.4.9 Полная несмешиваемость в жидком и в твердом состояниях
- •1.4.10 Системы с расслаиванием в жидком состоянии. Стабильное и
- •1.4.11 Системы с образованием химических соединений (двухкомпонентные
- •1.4.12 Системы с образованием химических соединений (двухкомпонентные
- •1.4.13 Трёхкомпонентные системы (принципы изображения,
- •1.4.14 Комбинация элементов диаграмм состояний. Физико-химический анализ.
- •2. Фазовые переходы и кинетическая теория стеклования
- •2.1 Стеклование
- •2.1.1 Принципиальная особенность фазовых переходов I и II рода в общей
- •2.1.2 Природа взаимодействия в конденсированных системах (общие
- •Ионное взаимодействие
- •Взаимодействие в металлах
- •Ковалентное взаимодействие
- •Водородные связи
- •Взаимодействие Ван-дер-Ваальса
- •Энергия химических связей
- •2.1.3 Основные особенности строения жидкостей и принцип их обобщенного
- •2.1.4 Общие сведения о релаксационных процессах как о процессах перехода от
- •2.1.5 Равновесные и мгновенные свойства жидкостей
- •2.1.6 Переохлажденные жидкости как частный случай метастабильного
- •2.1.7 Проявление стеклования на свойствах жидкостей
- •2.1.8 Определение стеклообразного состояния как лабильного (абсолютно
- •2.1.9 Математическое описание стеклования в кинетической теории. Твердо- и
- •2.1.10 Время релаксации структуры и его зависимость от температуры.
- •2.1.11 Соотношение температур стеклования и плавления (правило «2/3»
- •2.2 Кристаллизация расплавов стекол
- •2.2.1 Термодинамические особенности метастабильной жидкости
- •2.2.2 Работа образования зародыша кристаллизации20
- •2.2.3 Кривые Таммана а) скорость зарождения и кривая зарождения.
- •Б) скорость роста и кривая роста.
- •2.2.4 Методы изучения кристаллизационной способности и её
- •А) политермический метод и диаграммы кристаллизационной способности
- •Б) фазовый состав и морфология кристаллов.
- •В) дифференциальный термический анализ.
- •Г) скорость кристаллизации
- •2.2.5 Типы кристаллизации
- •2.2.6 Катализированная кристаллизация; ситаллы
- •2.2.7 Связь кристаллизационной способности с диаграммой состояния
- •3.Термодинамика стеклообразного состояния
- •3.1.1 Термодинамические переменные, используемые при математическом
- •3.1.2 Математическое описание избыточной свободной энергии лабильной
- •3.1.3 Математическое условие стеклования, налагаемое на изменения
- •3.1.4 Соотношение Пригожина-Дефея и его экспериментальная проверка
- •3.1.5 Термодинамический инвариант стеклообразного состояния
- •3.1.6 Следствия, вытекающие из соотношений термодинамики
1.3.4 Фазовые переходы I рода. Барическая зависимость фазовых переходов I рода:
соотношение Клаузиуса-Клапейрона. Сопоставление теплот переходов
с энергиями разрыва связей.
Фазовые переходы I рода в кристаллическом состоянии практически всегда связаны с изменением типа кристаллической структуры (вида элементарной ячейки). Это – так называемые полиморфные превращения, которые связывают разные кристаллические модификации либо простого вещества, либо кристаллического соединения. Как правило, при более высоких температурах устойчивы структуры с более низкой симметрией, при низких – с более высокой. Например, если элементарная ячейка – простая кубическая, то по отношению к ней ромбоэдрическая ячейка рассматривается как имеющая более низкую симметрию. Фазовые переходы такого типа происходят либо при изменении температуры, либо при изменении давления.
Зависимость температуры ф.п. I рода от давления определено уравнением Клаузиуса-Клапейрона:
![]() =
=
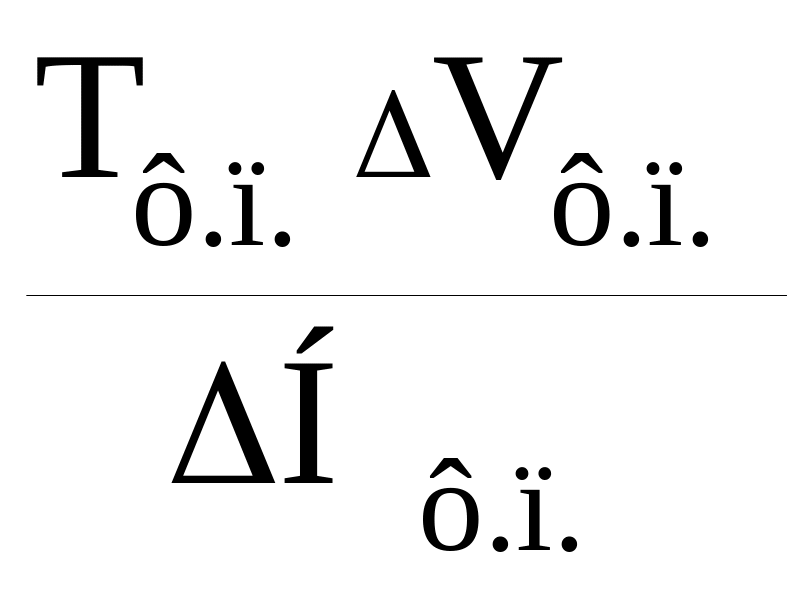 =
=
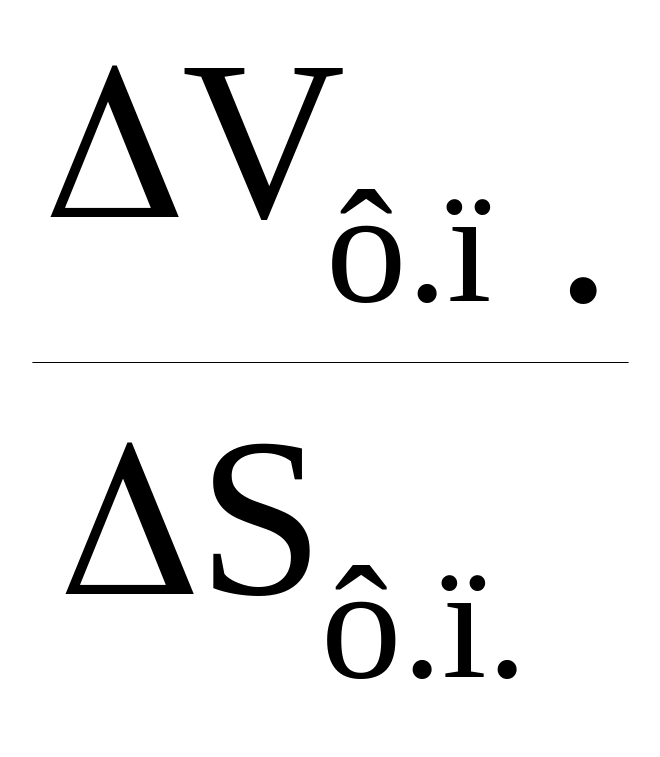 .
.
Поскольку ∆Sф.п. > 0, температура ф.п. будет повышаться или понижаться в зависимости от того, положительно или отрицательно изменение объема ∆Vф.п.. Подавляющее большинство веществ плавится с расширением, поэтому с повышением давления Тпл. возрастает. Однако некоторые вещества (например, вода, кремнезём) плавятся с уменьшением объема. Эффект давления здесь обратный.
Величины ∆Hпл. всегда невелики. Например, для плавления кристобалита (SiO2) при 2000 К это 8 кДж/моль. Энергия разрыва химических связей в моле SiO2 составляет 1800 кДж/моль (см. таблицу 3). Поэтому неправильно объяснять эффект плавления разрывом связей. Теплота идёт на изменение конфигурации в расположении атомов (изменяется структура), причем даже это изменение незначительно, так как сама энтропия плавления тоже невелика (∆Sпл. = 8000 Дж/моль/2000К = 4 Дж/моль∙К). Возможно, при плавлении и происходит разрыв связей, что определит скорость разрушения кристалла, но эти связи тут же восстанавливаются в новой структурной конфигурации.
1.4 Теория фазовых равновесий
1.4.1 Понятия «фазовые равновесия», «компонент», «диаграмма состояний»,
«линия фазовых равновесий». Работы Гиббса и Розебома. Значение
диаграмм состояния в современном материаловедении
Фазовые равновесия рассматриваются как в курсах теоретической физики, так и во всех без исключения курсах материаловедения (см. «Вводные замечания». Для каждой области материаловедения значение фазовых равновесий специфично. Для нашего курса фазовые равновесия необходимы для того, чтобы понять специфику свойств и технологии стеклообразных и стеклокристаллических материалов.
Термин «фаза» был введен ранее. Это - однородная часть гетерогенной системы, обладающая во всех точках одинаковым химическим составом и одинаковыми термодинамическими свойствами и отделенная от других фаз поверхностью раздела.
«Фазовое равновесие» - явление бесконечно долгого сосуществования нескольких (2-х и более) фаз при постоянстве выбранных параметров состояния.
«Диаграмма состояния» - графическое изображение зависимости между параметрами состояния физико-химической системы (р, Т, V и составом) и областями существования определенных фаз.
«Линия фазовых равновесий» - геометрическое место точек, определяющих условия равновесия (обычно при постоянном давлении это линии «температура – состав»).
«Компоненты» - вещества, наименьшее число которых достаточно для выражения состава всех фаз системы.
Диаграммы состояний (фазовые диаграммы или диаграммы равновесий) наглядно показывают, при какой температуре (давлении и пр.) какие фазы существуют в системе и как меняется состав, номенклатура и количество фаз при изменении и температуры (давления и пр.). Поскольку свойства каждого материала определены его структурой, знание диаграмм состояния обязательно как при разработке новых материалов с нужными свойствами, так и при переработке (использовании) имеющихся материалов для разных целей.
В основе термодинамической теории фазовых равновесий лежат классические работы великого американского физика и математика Дж.В. Гиббса (1839 – 1903). Голландский физико-химик Г.Розебом в конце 19 в. «перевёл» математическую форму работ Гиббса на язык геометрических образов диаграмм состояния и дал их систематику.
