- •Специальные разделы оптического материаловедения
- •Термодинамика фазовых равновесий
- •1.1 Общие сведения о термодинамике
- •1 Предмет термодинамики1
- •1.1.2 Термодинамическая система, виды систем
- •Изолированные системы – те, которые не имеют возможности обмениваться веществом и энергией с окружением и имеющие постоянный объем.
- •1.1.3 Параметры состояния, параметры процессов
- •1.1.4 Функции состояния
- •1.1.5 Виды процессов
- •1.1.6 Внутренняя энергия, теплота и работа
- •1.1.7 Максимальная работа при изобарических, изотермических, адиабатических и изохорных процессах
- •1.2 Законы термодинамики
- •1.2.2 II закон термодинамики и энтропия как термодинамическая функция
- •1.2.3 Энтропия и термодинамическая вероятность. III закон термодинамики
- •Следствия Законов
- •1.2.5 Термодинамические функции, важные для материаловедения.
- •1.2.6 Применение термодинамических понятий в других областях науки
- •1.3 Производные термодинамических потенциалов и фазовые переходы
- •1.3.1 Первые производные термодинамических потенциалов, их физический
- •1.3.2 Вторые производные термодинамических потенциалов (соотношения
- •1.3.3 Фазовые переходы I и II рода.
- •1.3.4 Фазовые переходы I рода. Барическая зависимость фазовых переходов I рода:
- •1.4 Теория фазовых равновесий
- •1.4.1 Понятия «фазовые равновесия», «компонент», «диаграмма состояний»,
- •1.4.2 Понятие химического потенциала. Условия равновесия фаз. Правило фаз
- •1.4.3 Диаграмма состояний однокомпонентной системы
- •1.4.5 Эвтектики (двухкомпонентные системы). Линии ликвидуса и солидуса.
- •1.4.6 Твердые растворы (двухкомпонентные системы). Значение твердых
- •1.4.7 Ограниченные твердые растворы
- •1.4.8 Упорядочение твердых растворов
- •1.4.9 Полная несмешиваемость в жидком и в твердом состояниях
- •1.4.10 Системы с расслаиванием в жидком состоянии. Стабильное и
- •1.4.11 Системы с образованием химических соединений (двухкомпонентные
- •1.4.12 Системы с образованием химических соединений (двухкомпонентные
- •1.4.13 Трёхкомпонентные системы (принципы изображения,
- •1.4.14 Комбинация элементов диаграмм состояний. Физико-химический анализ.
- •2. Фазовые переходы и кинетическая теория стеклования
- •2.1 Стеклование
- •2.1.1 Принципиальная особенность фазовых переходов I и II рода в общей
- •2.1.2 Природа взаимодействия в конденсированных системах (общие
- •Ионное взаимодействие
- •Взаимодействие в металлах
- •Ковалентное взаимодействие
- •Водородные связи
- •Взаимодействие Ван-дер-Ваальса
- •Энергия химических связей
- •2.1.3 Основные особенности строения жидкостей и принцип их обобщенного
- •2.1.4 Общие сведения о релаксационных процессах как о процессах перехода от
- •2.1.5 Равновесные и мгновенные свойства жидкостей
- •2.1.6 Переохлажденные жидкости как частный случай метастабильного
- •2.1.7 Проявление стеклования на свойствах жидкостей
- •2.1.8 Определение стеклообразного состояния как лабильного (абсолютно
- •2.1.9 Математическое описание стеклования в кинетической теории. Твердо- и
- •2.1.10 Время релаксации структуры и его зависимость от температуры.
- •2.1.11 Соотношение температур стеклования и плавления (правило «2/3»
- •2.2 Кристаллизация расплавов стекол
- •2.2.1 Термодинамические особенности метастабильной жидкости
- •2.2.2 Работа образования зародыша кристаллизации20
- •2.2.3 Кривые Таммана а) скорость зарождения и кривая зарождения.
- •Б) скорость роста и кривая роста.
- •2.2.4 Методы изучения кристаллизационной способности и её
- •А) политермический метод и диаграммы кристаллизационной способности
- •Б) фазовый состав и морфология кристаллов.
- •В) дифференциальный термический анализ.
- •Г) скорость кристаллизации
- •2.2.5 Типы кристаллизации
- •2.2.6 Катализированная кристаллизация; ситаллы
- •2.2.7 Связь кристаллизационной способности с диаграммой состояния
- •3.Термодинамика стеклообразного состояния
- •3.1.1 Термодинамические переменные, используемые при математическом
- •3.1.2 Математическое описание избыточной свободной энергии лабильной
- •3.1.3 Математическое условие стеклования, налагаемое на изменения
- •3.1.4 Соотношение Пригожина-Дефея и его экспериментальная проверка
- •3.1.5 Термодинамический инвариант стеклообразного состояния
- •3.1.6 Следствия, вытекающие из соотношений термодинамики
2.1.2 Природа взаимодействия в конденсированных системах (общие
ведения: ионное, металлическое, ковалентное взаимодействия,
водородные связи, взаимодействие Ван-дер-Ваальса. Энергии связей и их
пространственный характер)
Ионное взаимодействие
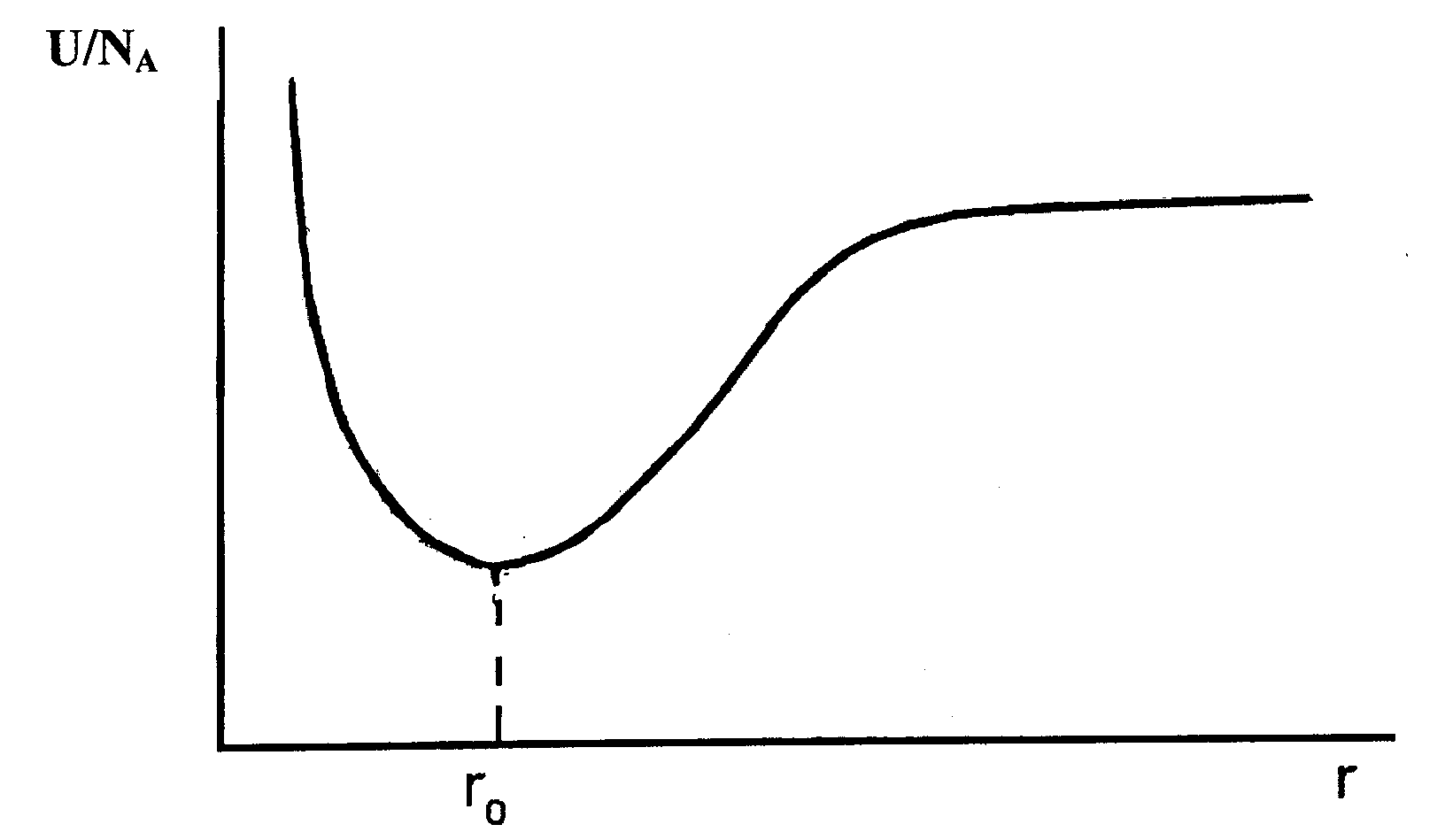
Энергия взаимодействующих заряженных частиц определена для условия равновесия структуры координат равенством между силами притяжения и силами отталкивания, рис. 19.
|
Рис. 19. Зависимость энергии взаимодействия частиц от расстояния r между ними. r0 соответствует равновесию сил притяжения и отталкивания. |
Для системы, выигрыш энергии которой описывается электростатическим взаимодействием (закон Кулона), имеем выражение для энергии15
U = - AZ1Z2e2/r + B/rn .
Z1 и Z2 – заряды ионов, e – заряд электрона, r – расстояние между ионами в структуре. Силы отталкивания изменяются от расстояния более быстро, чем силы притяжения в законе Кулона. Для условия равновесия (минимума энергии) при Z1 и Z2 = 1 имеем
U = –
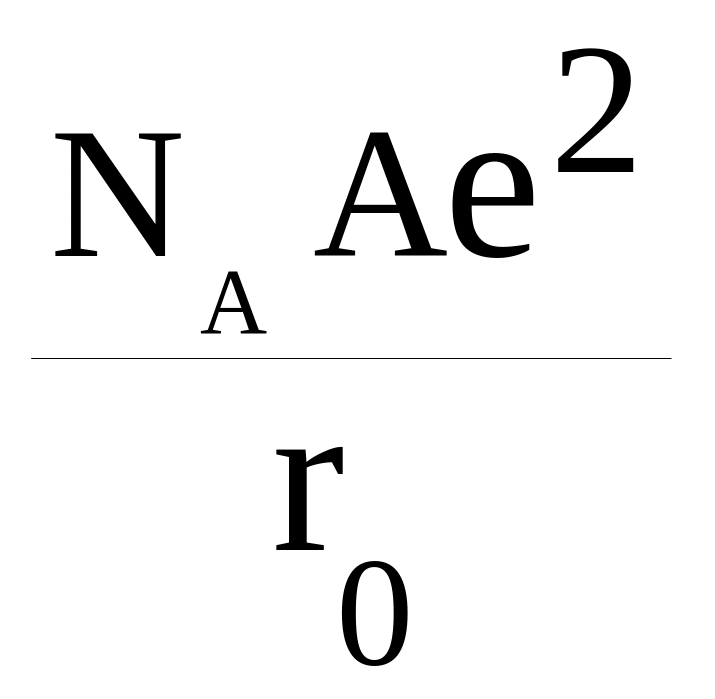 (1 –
(1 –
![]() ).
).
При более точном рассмотрении в выражении для энергии появляются дополнительные слагаемые, обусловленные более дальним, чем в пределах ближайшего окружения, взаимодействием, куда входит так называемая постоянная Маделунга. Для кристаллических структур соответствующие постоянные рассчитываются исходя из геометрических соображений, для стекол они также известны как теоретически ожидаемые. Величины n находят из упругих свойств (сжимаемости), они обычно для разных веществ изменяются от 5 до 12.
В ионных структурах координационные числа чаще всего бывают равными 6 или 8, они могут быть для разноименно заряженных атомов разными.
Взаимодействие в металлах
Эти структуры обладают минимумом энергии, соответствующим распределению валентных электронов по зонам Бриллуэна, форма которых в координатах вектора обратной решетки зависит от типа кристаллической структуры. Энергия взаимодействия может быть рассчитана в различных приближениях межатомного потенциала. Наиболее простым является потенциал Ми-Грюнайзена
U = - A/rm + B/rn.
Здесь потенциал притяжения (в отличие от кулоновского) меняется как 1/ rm, а потенциал отталкивания – как 1/ rn.
Значения m обычно около 3, n изменяется в пределах от 6 до 12.
Координационные числа в структурах простых металлов 8 или 12.
В последние десятилетия интенсивно исследуются стекла, образованные металлами и их сплавами. Они чрезвычайно важны для функционирования информационных систем и точных механических устройств.
Ковалентное взаимодействие
Этот тип взаимодействия лишь отчасти связан с возникновением положительных или отрицательных эффективных зарядов на атомах. Основное взаимодействие осуществляется за счет перекрытия атомных волновых функций. Бывают связи p-типа, гибридные связи sp, sp2, sp3 типов и промежуточные между ними. Координационные числа атомов невелики и определяются типом перекрываня орбиталей. Таким образом возникают цепочечные структуры (КЧ = 2, sp – гибридизация), структуры с КЧ = 3 (sp2 – гибридные связи), структуры типа алмаза (тетраэдрическое окружение, как в структурных единицах SiO2, КЧ = 4, sp3 гибридизация).
Уравнения для потенциалов взаимодействия разнообразны. Наиболее широко применяем в настоящее время потенциал Леннарда-Джонса (тип 6-12):
U = 4ε[–
(![]() )6
+ (
)12],
)6
+ (
)12],
где ε – максимальное значение энергии притяжения или глубина потенциальной ямы; σ – то значение межатомного расстояния, при котором U = 0. Известны многие другие виды потенциалов, которые мы здесь не рассматриваем.
При энергиях структуры, близких к энергиям в ионных кристаллах, для этого типа взаимодействия характерно очень сильное изменение энергии при изменении межатомных расстояний.
Химическая связь в большинстве веществ, образующих стекла, является ковалентной, или ионно-ковалентной.