- •Специальные разделы оптического материаловедения
- •Термодинамика фазовых равновесий
- •1.1 Общие сведения о термодинамике
- •1 Предмет термодинамики1
- •1.1.2 Термодинамическая система, виды систем
- •Изолированные системы – те, которые не имеют возможности обмениваться веществом и энергией с окружением и имеющие постоянный объем.
- •1.1.3 Параметры состояния, параметры процессов
- •1.1.4 Функции состояния
- •1.1.5 Виды процессов
- •1.1.6 Внутренняя энергия, теплота и работа
- •1.1.7 Максимальная работа при изобарических, изотермических, адиабатических и изохорных процессах
- •1.2 Законы термодинамики
- •1.2.2 II закон термодинамики и энтропия как термодинамическая функция
- •1.2.3 Энтропия и термодинамическая вероятность. III закон термодинамики
- •Следствия Законов
- •1.2.5 Термодинамические функции, важные для материаловедения.
- •1.2.6 Применение термодинамических понятий в других областях науки
- •1.3 Производные термодинамических потенциалов и фазовые переходы
- •1.3.1 Первые производные термодинамических потенциалов, их физический
- •1.3.2 Вторые производные термодинамических потенциалов (соотношения
- •1.3.3 Фазовые переходы I и II рода.
- •1.3.4 Фазовые переходы I рода. Барическая зависимость фазовых переходов I рода:
- •1.4 Теория фазовых равновесий
- •1.4.1 Понятия «фазовые равновесия», «компонент», «диаграмма состояний»,
- •1.4.2 Понятие химического потенциала. Условия равновесия фаз. Правило фаз
- •1.4.3 Диаграмма состояний однокомпонентной системы
- •1.4.5 Эвтектики (двухкомпонентные системы). Линии ликвидуса и солидуса.
- •1.4.6 Твердые растворы (двухкомпонентные системы). Значение твердых
- •1.4.7 Ограниченные твердые растворы
- •1.4.8 Упорядочение твердых растворов
- •1.4.9 Полная несмешиваемость в жидком и в твердом состояниях
- •1.4.10 Системы с расслаиванием в жидком состоянии. Стабильное и
- •1.4.11 Системы с образованием химических соединений (двухкомпонентные
- •1.4.12 Системы с образованием химических соединений (двухкомпонентные
- •1.4.13 Трёхкомпонентные системы (принципы изображения,
- •1.4.14 Комбинация элементов диаграмм состояний. Физико-химический анализ.
- •2. Фазовые переходы и кинетическая теория стеклования
- •2.1 Стеклование
- •2.1.1 Принципиальная особенность фазовых переходов I и II рода в общей
- •2.1.2 Природа взаимодействия в конденсированных системах (общие
- •Ионное взаимодействие
- •Взаимодействие в металлах
- •Ковалентное взаимодействие
- •Водородные связи
- •Взаимодействие Ван-дер-Ваальса
- •Энергия химических связей
- •2.1.3 Основные особенности строения жидкостей и принцип их обобщенного
- •2.1.4 Общие сведения о релаксационных процессах как о процессах перехода от
- •2.1.5 Равновесные и мгновенные свойства жидкостей
- •2.1.6 Переохлажденные жидкости как частный случай метастабильного
- •2.1.7 Проявление стеклования на свойствах жидкостей
- •2.1.8 Определение стеклообразного состояния как лабильного (абсолютно
- •2.1.9 Математическое описание стеклования в кинетической теории. Твердо- и
- •2.1.10 Время релаксации структуры и его зависимость от температуры.
- •2.1.11 Соотношение температур стеклования и плавления (правило «2/3»
- •2.2 Кристаллизация расплавов стекол
- •2.2.1 Термодинамические особенности метастабильной жидкости
- •2.2.2 Работа образования зародыша кристаллизации20
- •2.2.3 Кривые Таммана а) скорость зарождения и кривая зарождения.
- •Б) скорость роста и кривая роста.
- •2.2.4 Методы изучения кристаллизационной способности и её
- •А) политермический метод и диаграммы кристаллизационной способности
- •Б) фазовый состав и морфология кристаллов.
- •В) дифференциальный термический анализ.
- •Г) скорость кристаллизации
- •2.2.5 Типы кристаллизации
- •2.2.6 Катализированная кристаллизация; ситаллы
- •2.2.7 Связь кристаллизационной способности с диаграммой состояния
- •3.Термодинамика стеклообразного состояния
- •3.1.1 Термодинамические переменные, используемые при математическом
- •3.1.2 Математическое описание избыточной свободной энергии лабильной
- •3.1.3 Математическое условие стеклования, налагаемое на изменения
- •3.1.4 Соотношение Пригожина-Дефея и его экспериментальная проверка
- •3.1.5 Термодинамический инвариант стеклообразного состояния
- •3.1.6 Следствия, вытекающие из соотношений термодинамики
1.4.6 Твердые растворы (двухкомпонентные системы). Значение твердых
растворов в материаловедении
Различные виды диаграмм состояния систем с твердыми растворами приведены на рис. 10 слева. Для образования твердых растворов необходима близость структуры веществ (совпадение типов элементарных ячеек Бравэ и различие в размерах атомов или ионов, не превышающее 10%, если речь идет о металлических или солевых системах). На рис.10
справа показана последовательность выделения фаз. Как и выше, со стороны жидкости имеем линию ликвидуса (B′GFDA′), со стороны кристаллической фазы – линию солидуса (B′LСTA′). Пусть жидкость из точки М охлаждается до точки D. При этой температуре становится возможным ё сосуществование с твердой фазой, которой отвечает точка Е. Точка Е по составу отличается от состава исходной жидкости. Однако, это однородная кристаллическая фаза, имеющая структуру типа А (или В), но в которой часть атомов А заменена атомами В. При дальнейшем понижении температуры состав жидкости меняется в направлении D→G. Это обеспечивается переходом атомов В из жидкости в твердую фазу. Состав кристаллической фазы меняется за счёт достаточно быстрой диффузии в твердом состоянии от точки Е к точке L. Наконец, состав кристаллической фазы оказывается совпадающим с составом исходной жидкости (вертикаль ММ′). При дальнейшем понижении температуры твердый раствор только остывает.
-

Рис. 10. Диаграммы состояния двухкомпонентных систем, образующих
непрерывный ряд твердых растворов (пояснения в тексте).
Микроструктура твердых растворов, наблюдаемая в микроскоп, всегда фазово однородна. Правило Вегарда состоит в том, что параметр элементарной ячейки твердых растворов при изменении состава изменяются линейно или почти линейно.
Студентам предоставляется возможность самим нарисовать характер температурных кривых в процессе охлаждения расплава и определить вариантность линий. Паровая фаза не учитывается.
Твердые растворы важны как для материаловедения кристаллических веществ, так и стекол. В полупроводниковом материаловедении на использовании твердых растворов основана возможность постепенного изменения ширины запрещенной зоны и других характеристик (например, сплавы Ge-Si). В оптическом материаловедении на образовании твердых растворов основаны составы элементов, генерирующих лазерное излучение, когда в матрицу оптически однородного кристалла (например, корунда Al2O3) вводится активатор, Cr2O3. Образование твердых растворов в кристаллическом состоянии является гарантией того, что стекла в этой системе не возникнут неоднородности , связанные с фазовым разделением.
В ювелирном деле с древнейших времен использовались твердые растворы Au-Cu.
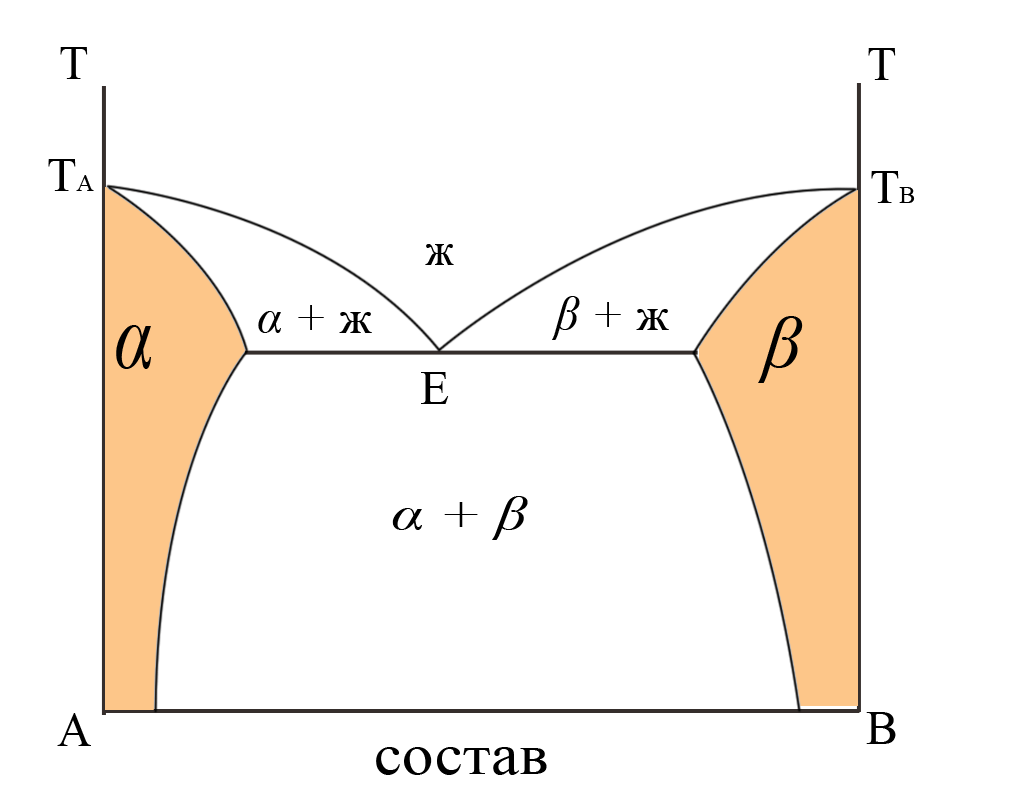
1.4.7 Ограниченные твердые растворы
Этот вид диаграмм состояния представляет комбинацию твердых растворов и эвтектического типа кристаллизации (рис. 11). Оба компонента (А и В) при небольших добавках другого начинают свои ряда твердых растворов (α и β). Однако при концентрации, превышающей некоторую максимальную для каждого из них, твердые растворы не могут существовать (из-за прогрессирующих искажений в кристаллической структуре каждого компонента и ограничения тем самым взаимной растворимости). Тогда начинается кристаллизация эвтектики (Е), образованных этими предельными по концентрации, насыщенными твердыми растворами. Дальнейшее понижение температуры приводит к уменьшению растворимости каждого компонента в чужом твердом растворе.
Такой вид диаграмм также очень распространен, потому что на самом деле каждая структура в принципе может воспринять искажающие её атомы или ионы, но в ограниченном количестве. Велика ли окажется эта предельная концентрация, зависит от конкретного случая.
|
Рис. 11. Диаграмма состояния двухкомпонентной системы, в которой образуется ограниченный ряд твердых растворов. Пояснения см. в тексте. |