
- •Глава 18. Электрохимические элементы
- •18.1. Электрохимические элементы. Электродвижущая сила
- •18.2. Термодинамика электрохимических элементов
- •18.3. Эдс как сумма скачков потенциалов
- •18.4. Двойной электрический слой
- •18.4.1. Электрокапиллярные явления
- •18.5. Электродные потенциалы
- •18.6.Типы электродов
- •18.6.1. Электроды первого рода
- •18.6.2. Электроды второго рода
- •18.6.3. Окислительно-восстановительные электроды
- •18.6.4. Мембранные электроды
- •Стеклянные электроды.
- •Другие ионоселективные электроды.
- •18.7. Типы электрохимических цепей
- •18.7.1.Химические цепи без переноса.
- •18.7.2. Концентрационные цепи без переноса
- •18.7.3. Химические цепи с переносом
- •18.7.4. Концентрационные цепи с переносом
- •18.7.5. Диффузионные потенциалы
- •18.8. Потенциометрия
- •18.8.1. Определение коэффициентов активности электролитов
- •18.8.2. Определение константы диссоциации слабой кислоты
- •18.8.3. Определение рН растворов
- •18.8.4. Определение произведения растворимости
- •18.8.5. Потенциометрическое титрование
18.6.3. Окислительно-восстановительные электроды
Как было сказано, в окислительно-восстановительных электродах (или редокс-электродах) раствор содержит окисленную и восстановленную форму какого-либо вещества (Fe3+ – Fe2+, Sn4+ – Sn2+, MnO2 –Mn2+, H3AsO4 – H3AsO3 и т.п.). Металл электрода служит лишь посредником в обмене электронами между двумя формами. Если обозначить окисленную и восстановленную формы вещества соответственно через Ох и Red, то уравнение электродной реакции в простейшем случае представляется в виде
Ox + ze L Red,
а потенциал окислительно-восстановительного электрода
![]() . (18.45)
. (18.45)
Например, для системы Fe3+/Fe2+ потенциал
![]() . (18.46)
. (18.46)
Если возникающая на электроде первичная
частица реагирует с растворителем или
с его ионом, то в выражение для потенциала
входят активности этих реагентов.
Например, для электрода
![]() /Cr3+
электродная реакция протекает по
уравнению
/Cr3+
электродная реакция протекает по
уравнению
+ 14H+ + 6e L 2Cr3+ + 7H2O,
а потенциал
 . (18.47)
. (18.47)
Стандартный потенциал является мерой
окислительной или восстановительной
способности веществ. Если
![]() ,
то система 1 является более сильным
окислителем, чем система 2. Следовательно,
в растворе, где первоначально aRed,1
= aOx,1 и aRed,2 = aOx,2,
установится равновесие, при котором
aRed,1 > aOx,1 и aRed,2
< aOx,2. Если в электродной
окислительно-восстановительной реакции
участвует ион водорода, то стандартный
потенциал о
определяют при активности ионов водорода,
равной единице, т.е. при рН = 0. Часто
оказывается возможным, варьируя рН,
изменить положение редокс-систем в ряду
по окислительной способности.
,
то система 1 является более сильным
окислителем, чем система 2. Следовательно,
в растворе, где первоначально aRed,1
= aOx,1 и aRed,2 = aOx,2,
установится равновесие, при котором
aRed,1 > aOx,1 и aRed,2
< aOx,2. Если в электродной
окислительно-восстановительной реакции
участвует ион водорода, то стандартный
потенциал о
определяют при активности ионов водорода,
равной единице, т.е. при рН = 0. Часто
оказывается возможным, варьируя рН,
изменить положение редокс-систем в ряду
по окислительной способности.
Хингидронный электрод. Редокс-систему этого электрода образует хингидрон – эквимолярная смесь хинона С6Н4О2 и гидрохинона С6Н4(ОН)2, которые мало растворимы в воде и уже при небольших добавках к раствору образуют насыщенный раствор. Обозначив для краткости хинон через Q и гидрохинон – QH2, уравнение реакции в полуэлементе можно представить в виде:
Q + 2e L Q2–
Гидрохинон представляет собою слабую двухосновную кислоту, константы диссоциации которой равны
QH2
L
QH–
+ H+
![]() (18.48)
(18.48)
QH–
L
Q2–
+ H+
![]() . (18.49)
. (18.49)
Уравнение для потенциала хингидронного электрода имеет вид
![]() . (18.50)
. (18.50)
Концентрацию аниона можно рассчитать
с помощью уравнений для констант
диссоциации и уравнения для аналитической
концентрации
![]() гидрохинона:
гидрохинона:
![]() =
[QH2] + [QH–] + [Q2–]
=
[QH2] + [QH–] + [Q2–]
![]() . (18.51)
. (18.51)
Отсюда получаем
![]() , (18.52)
, (18.52)
а потенциал хингидронного электрода
![]() . (18.53)
. (18.53)
В хингидроне [Q] =
![]() ,
поэтому второй член в правой части этого
уравнения равен нулю, а первое и третье
слагаемые можно объединить в одну
константу
,
поэтому второй член в правой части этого
уравнения равен нулю, а первое и третье
слагаемые можно объединить в одну
константу
![]() .
Четвертое слагаемое в некоторых
интервалах значений рН может упрощаться:
.
Четвертое слагаемое в некоторых
интервалах значений рН может упрощаться:
1) в кислой среде
![]()
и электродный потенциал
![]() , (18.54)
, (18.54)
где
![]() ;
;
2) если
![]() то
то
![]() (18.55)
(18.55)
3) в сильно щелочной области
![]()
происходит полная диссоциация гидрохинона и электродный потенциал не зависит от рН:
Рис. 18.7 Зависимость
потенциала
хингидронного электрода
от рН раствора.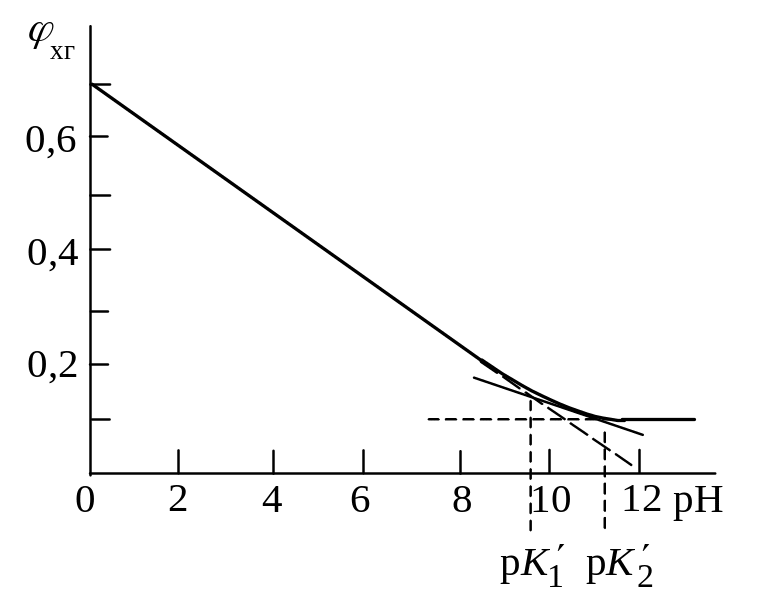
![]() . (18.56)
. (18.56)
Если представить зависимость потенциала хг от рН (рис. 18.7), то получается кривая с тремя линей-ными участками (второй участок плохо выражен) с наклонами 0,0591, 0,0295 и 0 В/pH при тем-пературе 25оС.
Точки пересечения двух соседних
экстраполированных линейных участков
дают величины
![]() и
и
![]() .
.
Таким образом, хингидронный электрод может применяться для определения рН в кислых и слабощелочных растворах (рН 8), но не пригоден для работы в щелочных средах (в сильнощелочной среде гидрохинон окисляется кислородом воздуха), а также в окислительной или восстановительной среде.
