
- •Глава 18. Электрохимические элементы
- •18.1. Электрохимические элементы. Электродвижущая сила
- •18.2. Термодинамика электрохимических элементов
- •18.3. Эдс как сумма скачков потенциалов
- •18.4. Двойной электрический слой
- •18.4.1. Электрокапиллярные явления
- •18.5. Электродные потенциалы
- •18.6.Типы электродов
- •18.6.1. Электроды первого рода
- •18.6.2. Электроды второго рода
- •18.6.3. Окислительно-восстановительные электроды
- •18.6.4. Мембранные электроды
- •Стеклянные электроды.
- •Другие ионоселективные электроды.
- •18.7. Типы электрохимических цепей
- •18.7.1.Химические цепи без переноса.
- •18.7.2. Концентрационные цепи без переноса
- •18.7.3. Химические цепи с переносом
- •18.7.4. Концентрационные цепи с переносом
- •18.7.5. Диффузионные потенциалы
- •18.8. Потенциометрия
- •18.8.1. Определение коэффициентов активности электролитов
- •18.8.2. Определение константы диссоциации слабой кислоты
- •18.8.3. Определение рН растворов
- •18.8.4. Определение произведения растворимости
- •18.8.5. Потенциометрическое титрование
18.2. Термодинамика электрохимических элементов
Рассмотрим электрохимический элемент, в котором обратимо и изотермически протекает реакция
zF
AA + BB + ... L LL + MM + ...
При постоянном давлении изменение энергии Гиббса равно электрической энергии системы:
– Gp,Т = – zFE, (18.1)
где z – число зарядов, участвующих в электродной реакции, F – число Фарадея.
ЭДС электрохимического элемента
![]() . (18.2)
. (18.2)
Изменение энергии Гиббса при реакции
G = ii, (18.3)
где i – химический потенциал i-го компонента, i – его стехиометрический коэффициент в уравнении реакции, величина которого принимается положительной для продуктов реакции и отрицательной для исходных веществ. Так как
i
=
![]() + RTlnai, (18.4)
+ RTlnai, (18.4)
то
G = i + RTi lnai = Go + RTi lnai. (18.5)
Стандартное изменение энергии Гиббса связано с константой равновесия реакции K соотношением Go = – RTlnK (см. раздел 11.3). С учетом знаков i можно тогда записать:
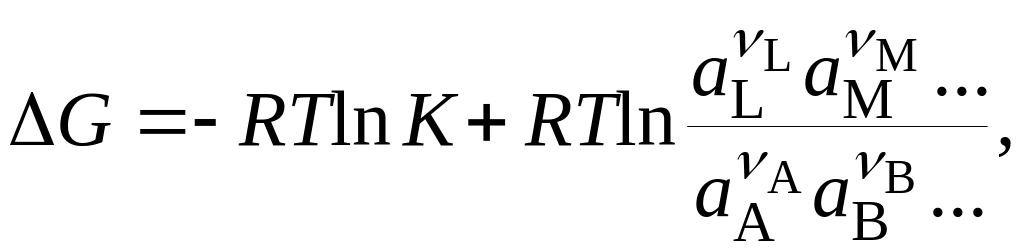 (18.6)
(18.6)
а уравнение (18.2) для ЭДС приобретает вид
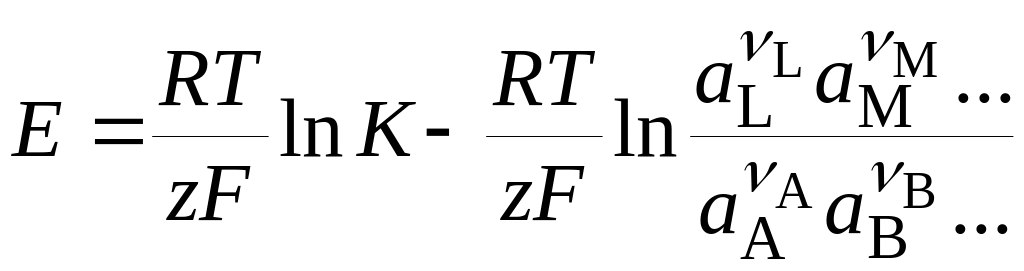 . (18.7)
. (18.7)
Если активности всех реагирующих веществ равны единице (ai = 1), то второй член справа обращается в нуль, и ЭДС элемента при заданной температуре является постоянной величиной, соответствующей константе равновесия:
![]() . (18.8)
. (18.8)
Величина Eo называется стандартной электродвижущей силой электрохимического элемента. Таким образом, ЭДС элемента
 . (18.9)
. (18.9)
Измерения ЭДС при разных температурах дают возможность рассчитать изменения энтальпии, изменения энтропии и других термодинамических функций на основе известных термодинамических соотношений. Так как
![]() , (18.10)
, (18.10)
то
![]() . (18.11)
. (18.11)
Электродвижущая сила отдельного электрохимического элемента по физическому смыслу является положительной величиной, так как она соответствует определенному самопроизвольно протекающему процессу, дающему положительную работу. Однако при изменении условий работы элемента (изменение концентрации, растворителя, температуры и т.д.) направление самопроизвольного процесса может измениться, что должно быть отмечено изменением знака ЭДС. Можно также составить электрохимическую цепь из нескольких элементов так, чтобы в одном из них протекал несамопроизвольный процесс за счет работы другого элемента цепи, в котором протекает самопроизвольный процесс. Суммарная ЭДС такой цепи равна алгебраической сумме положительных и отрицательных величин. Само понятие исходных и конечных веществ не является четко установленным, а зависит от вида записи уравнения реакции. Поэтому для одной и той же электрохимической системы, в зависимости от формы записи уравнения реакции, значения ЭДС могут отличаться по знаку, совпадая по абсолютной величине. Конечно, знаки “плюс” и “минус” являются чисто формальной характеристикой и указывают лишь на направление тока в цепи, а “отрицательная” ЭДС ничем качественно не отличается от “положительной”. Но эти различия в знаках очень важны при сопоставлении ЭДС различных элементов, комбинировании ЭДС и т.д.
Установить знак ЭДС без дополнительных условий нельзя, в связи с чем существовали две системы знаков – система, принятая в США, и система противоположных знаков, принятая в европейских странах. Для унификации системы знаков Международный союз теоретической и прикладной химии (IUPAC) в 1953 г. принял конвенцию, по которой для всех стран рекомендовалась европейская система знаков. В 1973 г. ряд положений конвенции было уточнено и дополнено.
Введение системы знаков связано с выполнением определенных правил записи составляющих электрохимической системы, отдельных электродных реакций и суммарной электрохимической реакции. Любой электрохимический элемент записывается следующим образом: вначале указывается материал одного из электродов, затем раствор, в котором он находится; далее раствор, контактирующий со вторым электродом (если он отличается от первого раствора), и, наконец, материал второго электрода. При такой записи все фазы электрохимического элемента отделяются друг от друга вертикальной чертой; вещества, входящие в фазы, обозначаются соответствующими химическими символами и отделяются запятыми. Растворы отделяются вертикальной чертой в случае их непосредственного контакта или двойной вертикальной чертой, если они соединяются электролитическим мостиком для элиминирования диффузионного потенциала. Например, запись
Cu | Zn | ZnSO4,aq | KCl, насыщ. р-р | KCl,aq | AgCl | Ag | Cu
обозначает электрохимический элемент, составленный из цинкового электрода, опущенного в водный раствор сульфата цинка, и хлорсеребряного электрода в водном растворе хлорида калия. Растворы соединены электролитическим мостиком. Запись можно упростить, не указывая в схеме цепи материал соединительных проводов (в данном примере медь), электролитического моста (насыщенный раствор KCl), а вместо полного указания соединений в растворах обозначить лишь ионы, от которых зависит потенциал:
Zn | Zn2+ || Cl– | AgCl | Ag
Электродвижущая сила электрохимического элемента считается положительной, если при работе элемента катионы в растворе идут от электрода, записанного слева, к электроду, записанному справа, а электроны во внешней цепи движутся в этом же направлении. В нашем примере на электродах протекают реакции:
Zn Zn2+ + 2e
2AgCl + 2e 2Ag + 2Cl–
Суммарный процесс:
Zn + 2AgCl Zn2+ + 2Ag + 2Cl–,
т.е. происходит растворение цинкового электрода и ионы цинка поступают в раствор (слева направо), а на электроде создается избыток электронов. Во втором растворе ионы Ag , образующиеся при растворении хлорида серебра, разряжаются на серебряном электроде (идут слева направо), создавая дефицит электронов. При замыкании цепи электроны будут переходить от цинкового электрода к хлорсеребряному, т.е. слева направо. Таким образом, по принятому условию о знаках ЭДС этого элемента положительна.
