
- •Глава 18. Электрохимические элементы
- •18.1. Электрохимические элементы. Электродвижущая сила
- •18.2. Термодинамика электрохимических элементов
- •18.3. Эдс как сумма скачков потенциалов
- •18.4. Двойной электрический слой
- •18.4.1. Электрокапиллярные явления
- •18.5. Электродные потенциалы
- •18.6.Типы электродов
- •18.6.1. Электроды первого рода
- •18.6.2. Электроды второго рода
- •18.6.3. Окислительно-восстановительные электроды
- •18.6.4. Мембранные электроды
- •Стеклянные электроды.
- •Другие ионоселективные электроды.
- •18.7. Типы электрохимических цепей
- •18.7.1.Химические цепи без переноса.
- •18.7.2. Концентрационные цепи без переноса
- •18.7.3. Химические цепи с переносом
- •18.7.4. Концентрационные цепи с переносом
- •18.7.5. Диффузионные потенциалы
- •18.8. Потенциометрия
- •18.8.1. Определение коэффициентов активности электролитов
- •18.8.2. Определение константы диссоциации слабой кислоты
- •18.8.3. Определение рН растворов
- •18.8.4. Определение произведения растворимости
- •18.8.5. Потенциометрическое титрование
18.4. Двойной электрический слой
Рис. 18.3. Образование
двойного
электрического слоя
Однако в действительности такая
структура нарушается тепловым движением
ионов, т.е. модель Гельмгольца
соответствовала бы действительности
при температуре абсолютного нуля или
при очень высоких концентрациях
электролита. В реальных условиях
тепловое движение приводит к тому, что
часть ионов уходит с поверхности и
образуют диффузную часть двойного
слоя. Таким образом, ДЭС можно представить
состоящим из плотной части, или
слоя Гельмгольца, и диффузной части
(рис. 18.4). Толщина плотной части d
приблизительно равна радиусу
сольватиро-ванного иона, а толщина
диффузной части
в зависимости от концен-трации и
температуры может колебаться в пределах
от нескольких ангстрем до нескольких
тысяч ангстрем.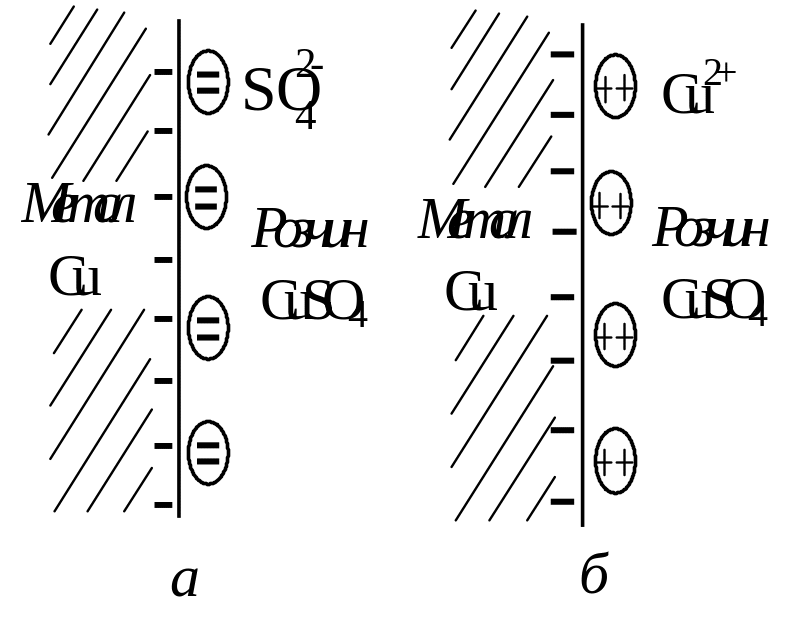
Рис. 18.4. Распределение
ионов в двойном электрическом слое: а
– распределение ионов; б
– схематическое
изображение
избыточных ионов; в
– изменение
концентрации ионов с
расстоянием от поверхности;
г
– распределение потенциала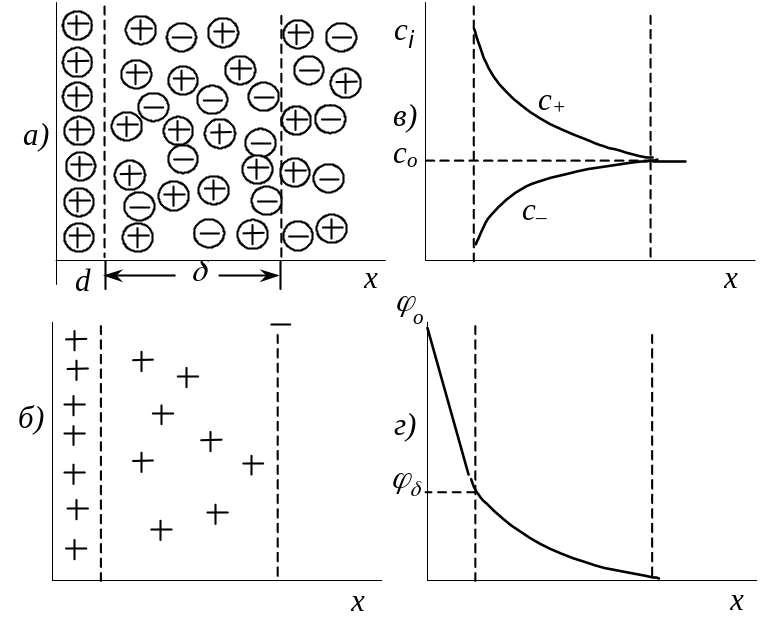
![]() в растворе больше, чем в металле, то
часть ионов Cu2+
перейдет в металл, на котором возникнет
избыточный положительный заряд.
Вследствие электростатического
притяжения в растворе, вблизи поверхности
раздела, возникнет отрицательно
заряженный слой из сульфат-ионов. Если
же химический потенциал ионов меди в
растворе меньше, чем в металле, то ионы
меди будут переходить в раствор, образуя
положительно заряженную обкладку
конденсатора, а металл зарядится
отрицательно (рис. 18.3).
в растворе больше, чем в металле, то
часть ионов Cu2+
перейдет в металл, на котором возникнет
избыточный положительный заряд.
Вследствие электростатического
притяжения в растворе, вблизи поверхности
раздела, возникнет отрицательно
заряженный слой из сульфат-ионов. Если
же химический потенциал ионов меди в
растворе меньше, чем в металле, то ионы
меди будут переходить в раствор, образуя
положительно заряженную обкладку
конденсатора, а металл зарядится
отрицательно (рис. 18.3).
Суммарный потенциал о можно представить в виде суммы потенциалов плотной части d, который изменяется с расстоянием линейно, и диффузной части ДЭС –.Согласно теории Гуи – Чепмена (1910), в диффузной области потенциал изменяется по экспоненциальному закону. В этой теории учитывается лишь кулоновское взаимодействие противоионов с ионами внутренней обкладки и не учитывается возможность специфической адсорбции противоионов под действием некулоновских (вандерваальсовых или химических) сил. Это специфическое взаимодействие, которое характерно для многозарядных ионов, ионов красителей, ПАВ, рассматривается в теории Штерна (1924). Штерн вводит понятие адсорбционного потенциала, который дает дополнительную (к кулоновской) энергию адсорбции ионов.
