
- •Глава 18. Электрохимические элементы
- •18.1. Электрохимические элементы. Электродвижущая сила
- •18.2. Термодинамика электрохимических элементов
- •18.3. Эдс как сумма скачков потенциалов
- •18.4. Двойной электрический слой
- •18.4.1. Электрокапиллярные явления
- •18.5. Электродные потенциалы
- •18.6.Типы электродов
- •18.6.1. Электроды первого рода
- •18.6.2. Электроды второго рода
- •18.6.3. Окислительно-восстановительные электроды
- •18.6.4. Мембранные электроды
- •Стеклянные электроды.
- •Другие ионоселективные электроды.
- •18.7. Типы электрохимических цепей
- •18.7.1.Химические цепи без переноса.
- •18.7.2. Концентрационные цепи без переноса
- •18.7.3. Химические цепи с переносом
- •18.7.4. Концентрационные цепи с переносом
- •18.7.5. Диффузионные потенциалы
- •18.8. Потенциометрия
- •18.8.1. Определение коэффициентов активности электролитов
- •18.8.2. Определение константы диссоциации слабой кислоты
- •18.8.3. Определение рН растворов
- •18.8.4. Определение произведения растворимости
- •18.8.5. Потенциометрическое титрование
18.8.5. Потенциометрическое титрование
Потенциометрическое титрование используют для определения концентрации электролитов, констант диссоциации, констант комплексообразования и т.д. Его можно применять в случаях окрашенных или мутных растворов, где невозможно титрование с помощью индикаторов. Для титрования используют цепи с переносом. Один из электродов – индикаторный – обратим к катионам или анионам титруемого вещества или титранта, другой – вспомогательный, или электрод сравнения,– имеет постоянный потенциал, который не меняется в процессе титрования:
Индикаторный электрод | Исследуемый раствор || Электрод сравнения
В ходе титрования к исследуемому раствору добавляют небольшими порциями титрант и каждый раз измеряют ЭДС цепи. Точку эквивалентности определяют по резкому изменению (скачку) ЭДС вблизи этой точки. Ход кривой титрования рассмотрим на примере кислотно-основного титрования. В качестве индикаторного используется электрод, обратимый к ионам водорода. Это может быть водородный электрод (что практически очень неудобно), хингидронный (в кислых и слабощелочных растворах) или стеклянный электроды. В качестве электрода сравнения часто применяют хлорсеребряный электрод, потенциал которого достаточно устойчив и имеет малый температурный коэффициент:
Стеклянный электрод | Исследуемый р-р (Н+) || КСl |AgCl|Ag
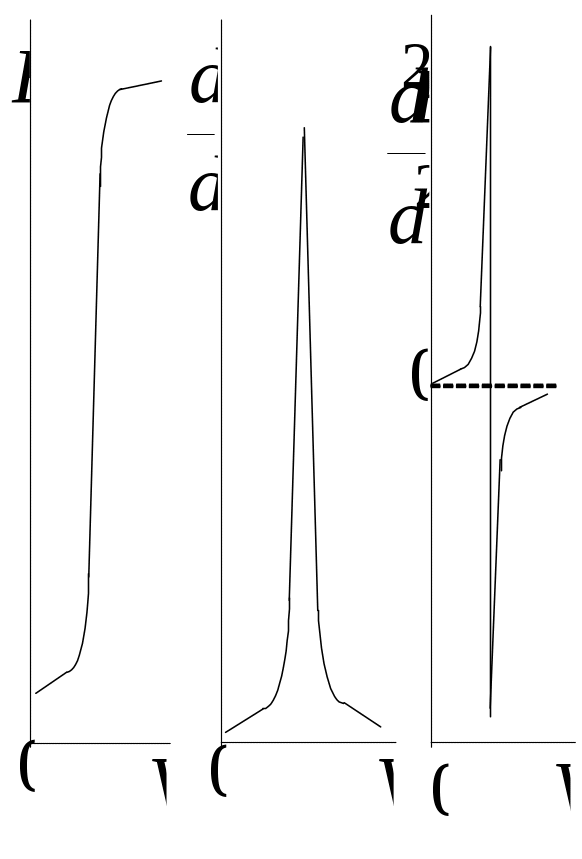
Рис. 18.9. Кривая потенциометрического титрования и ее производные
для случая титрования сильной кислоты сильным основанием.
ЭДС этой цепи равна разности потенциалов стеклянного и хлорсеребряного электродов, а также включает диффузионный потенциал. Но так как потенциал хлорсеребряного электрода остается неизменным, а диффузионный потенциал также меняется мало, то их величины и стандартный потенциал стеклянного электрода можно объединить в одну постоянную Ео. Тогда
![]() . (18.112)
. (18.112)
Как видно из этого соотношения, изменения Е в ходе титрования пропорциональны изменениям рН, т.е. ход кривой потенциометрического титрования Е – Vщ качественно полностью соответствует зависимости рН – Vщ (см. раздел 18.13).
При титровании слабых кислот (оснований) слабыми основаниями (кислотами) скачок потенциала на кривой титрования сильно размыт. Для точного нахождения точки эквивалентности строят дифференциальные кривые титрования E/V – V (в пределе dE/dV – V), на которых вместо перегиба в точке эквивалентности появляется экстремум. Зависимость вторых производных d2E/dV2 – V меняет знак в точке эквивалентности (рис. 18.9)
