
- •Глава 18. Электрохимические элементы
- •18.1. Электрохимические элементы. Электродвижущая сила
- •18.2. Термодинамика электрохимических элементов
- •18.3. Эдс как сумма скачков потенциалов
- •18.4. Двойной электрический слой
- •18.4.1. Электрокапиллярные явления
- •18.5. Электродные потенциалы
- •18.6.Типы электродов
- •18.6.1. Электроды первого рода
- •18.6.2. Электроды второго рода
- •18.6.3. Окислительно-восстановительные электроды
- •18.6.4. Мембранные электроды
- •Стеклянные электроды.
- •Другие ионоселективные электроды.
- •18.7. Типы электрохимических цепей
- •18.7.1.Химические цепи без переноса.
- •18.7.2. Концентрационные цепи без переноса
- •18.7.3. Химические цепи с переносом
- •18.7.4. Концентрационные цепи с переносом
- •18.7.5. Диффузионные потенциалы
- •18.8. Потенциометрия
- •18.8.1. Определение коэффициентов активности электролитов
- •18.8.2. Определение константы диссоциации слабой кислоты
- •18.8.3. Определение рН растворов
- •18.8.4. Определение произведения растворимости
- •18.8.5. Потенциометрическое титрование
18.7.1.Химические цепи без переноса.
Примером такой цепи является водород-хлорсеребряный элемент
Pt | (H2) | HCl | AgCl | Ag, (I)
который состоит из водородного и хлорсеребряного электродов, погруженных в раствор хлороводорода. При работе в таком элементе протекают электродные реакции:
1/2H2 (газ) H+ (р-р) + e
AgCl (тв) + e Ag (тв) + Cl– (р-р)
Таким образом, суммарный процесс представляет собой химическую реакцию
1/2H2 (газ) + AgCl (тв) Ag (тв) + Н+ (р-р) + Cl– (p-p)
ЭДС такой цепи равна разности потенциалов хлорсеребряного и водородного электродов. Учитывая уравнения (18.41) и (18.33) для этих электродов, получим
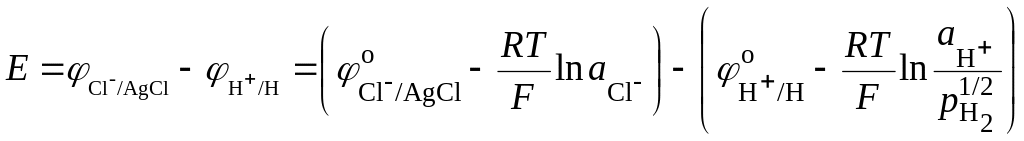 . (18.77)
. (18.77)
Разность стандартных потенциалов хлорсеребряного и водородного электродов дают стандартную ЭДС цепи Ео, но так как стандартный потенциал водородного электрода принят равным нулю, то Ео равна стандартному потенциалу хлорсеребряного электрода. Если давление водорода равно единице, то
![]() . (18.78)
. (18.78)
Если хлороводород полностью диссоциирован
в растворе, то произведение активностей
ионов водорода и хлора можно заменить
средней ионной активностью (см. раздел
15.3)
![]() ,
тогда
,
тогда
![]() . (18.79)
. (18.79)
Другим примером химической цепи без переноса может быть стандартный элемент Вестона
Hg, Cd | CdSO4 | Hg2SO4 | Hg, (II)
ЭДС которого характеризуется очень большим постоянством во времени и незначительным температурным коэффициентом. В элементе Вестона кадмиевый амальгамный электрод обратим к ионам кадмия:
Cd Cd2+ + 2e,
а ртуть-сульфатный – к сульфат-ионам:
Hg2SO4
+ 2e
2Hg +
![]()
Суммарное уравнение реакции можно представить в виде
Cd + Hg2SO4 Cd2+ + + 2Hg,
откуда для ЭДС элемента следует:
![]() . (18.80)
. (18.80)
Аналогично можно получить уравнения для ЭДС любой химической цепи без переноса.
18.7.2. Концентрационные цепи без переноса
Концентрационные цепи без переноса составляются из двух электродов одинаковой природы, но отличающихся по количественному составу. Оба электрода погружены в один и тот же раствор. Примером таких цепей являются цепи, составленные из амальгамных электродов с различной активностью (концентрацией) металла в ртути:
Hg, M(a1) | MA | M(a2), Hg (III)
Если а1 > a2, то на левом электроде металл растворяется и переходит в раствор в виде соответствующих ионов:
Hg,M(a1) Mz+ + ze + Hg,
а на правом электроде происходит такая же реакция в обратном направлении:
Mz+ + ze + Hg M(a2),Hg
Суммарный процесс сводится к переносу металла из более концентрированной амальгамы в более разбавленную:
Hg,M(a1) M(a2),Hg
ЭДС такой цепи
![]() . (18.81)
. (18.81)
Процесс будет протекать до тех пор, пока активности (концентрации) металла в амальгамах не уравняются.
Другим примером концентрационных цепей без переноса могут быть цепи, составленные из одинаковых газовых электродов, отличающихся давлением газа (водорода, хлора и т.п.):
Pt | H2(![]() )
| HCl | H2(
)
| HCl | H2(![]() )
| Pt (IV)
)
| Pt (IV)
В такой цепи при
![]() >
>![]() на правом электроде происходит ионизация
водорода с переходом ионом водорода в
раствор, на левом – разряд ионов водорода
с переходом образующегося водорода в
газовую фазу. ЭДС этой цепи
на правом электроде происходит ионизация
водорода с переходом ионом водорода в
раствор, на левом – разряд ионов водорода
с переходом образующегося водорода в
газовую фазу. ЭДС этой цепи
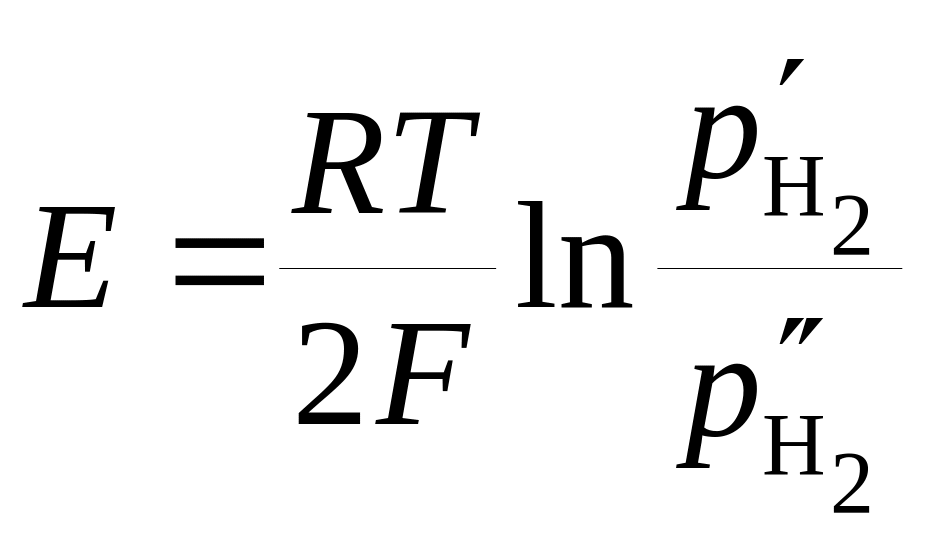 . (18.82)
. (18.82)
В случае подобной цепи из двух хлорных электродов
Pt | Cl2(![]() )
| HCl | Cl2(
)
| HCl | Cl2(![]() )
| Pt (V)
)
| Pt (V)
при > на правом электроде происходит ионизация хлора с образованием отрицательно заряженных ионов хлора, переходящих в раствор, на левом – разряд ионов хлора с дальнейшим переходом молекул хлора в газовую фазу. ЭДС цепи
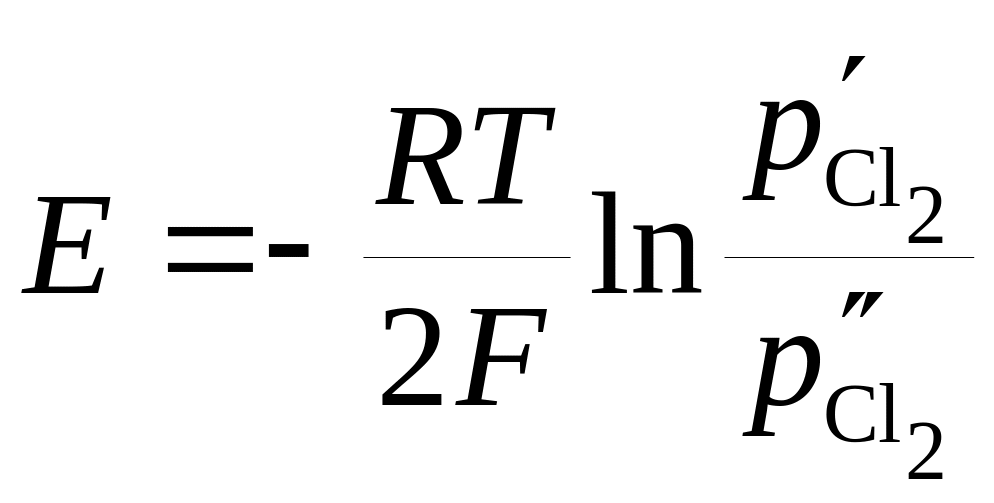 . (18.83)
. (18.83)
Из уравнений (18.81) – (18.83) видно, что ЭДС концентрационных цепей без переноса не зависит от концентрации электролита в растворе и природы растворителя.
