
- •Глава 18. Электрохимические элементы
- •18.1. Электрохимические элементы. Электродвижущая сила
- •18.2. Термодинамика электрохимических элементов
- •18.3. Эдс как сумма скачков потенциалов
- •18.4. Двойной электрический слой
- •18.4.1. Электрокапиллярные явления
- •18.5. Электродные потенциалы
- •18.6.Типы электродов
- •18.6.1. Электроды первого рода
- •18.6.2. Электроды второго рода
- •18.6.3. Окислительно-восстановительные электроды
- •18.6.4. Мембранные электроды
- •Стеклянные электроды.
- •Другие ионоселективные электроды.
- •18.7. Типы электрохимических цепей
- •18.7.1.Химические цепи без переноса.
- •18.7.2. Концентрационные цепи без переноса
- •18.7.3. Химические цепи с переносом
- •18.7.4. Концентрационные цепи с переносом
- •18.7.5. Диффузионные потенциалы
- •18.8. Потенциометрия
- •18.8.1. Определение коэффициентов активности электролитов
- •18.8.2. Определение константы диссоциации слабой кислоты
- •18.8.3. Определение рН растворов
- •18.8.4. Определение произведения растворимости
- •18.8.5. Потенциометрическое титрование
18.8.3. Определение рН растворов
Обычно определения рН растворов проводят по измерениям ЭДС цепей с переносом с использованием стандартных буферных растворов, для которых величина рНст установлена:
Индик. эл-д | ст. буферный р-р (рНст) || исслед. р-р (рНх) | Индик. эл-д
В качестве индикаторных применяют водородный или стеклянный электроды. ЭДС этой цепи, если не учитывать диффузионный потенциал, равна разности потенциалов двух индикаторных электродов:
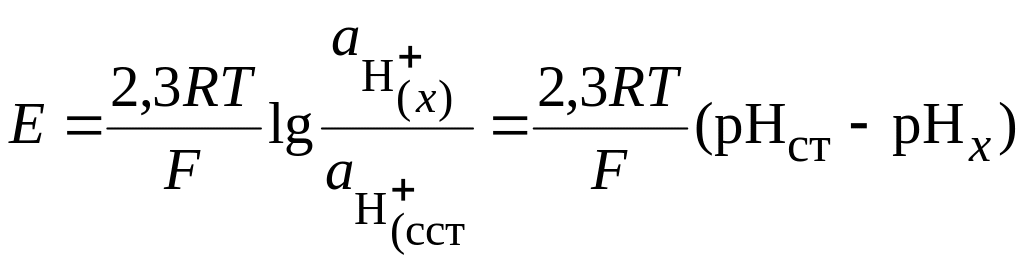 , (18.102)
, (18.102)
откуда
![]() . (18.103)
. (18.103)
На практике обычно проводят измерения ЭДС цепи
Индикаторный электрод | буферный р-р || Электрод сравнения
со стандартным буферным раствором (Ест) и исследуемым раствором (Ех). Разность ЭДС этих цепей
![]() , (18.104)
, (18.104)
что аналогично уравнению (18.102).
Таким образом, точность определения рНх зависит от точности установления рНст стандартного буферного раствора и погрешностей, связанных с наличием диффузионного потенциала. рН стандартных буферных растворов определяют потенциометрически по методу Американского Национального Бюро Стандартов (метод ANBS). Используется цепь без переноса с исследуемым буферным раствором, в который вводятся добавки хлорид-ионов:
Pt(H2) |H+ (станд. буф. р-р), Cl– | AgCl | Ag
ЭДС такой цепи
![]() . (18.105)
. (18.105)
Введем обозначение
![]() .
Тогда
.
Тогда
![]() . (18.106)
. (18.106)
Измерив ЭДС при различных значениях
![]() ,
рассчитывают величины pWH
(стандартная ЭДС цепи Ео
определяется как описано в разд. 18.8.1) и
строят график зависимости рWН от
,
рассчитывают величины pWH
(стандартная ЭДС цепи Ео
определяется как описано в разд. 18.8.1) и
строят график зависимости рWН от
![]() .
Линейной экстраполяцией на значение
=
0 получают величину pWHo
(индекс “о”
указывает, что
0). Значение
.
Линейной экстраполяцией на значение
=
0 получают величину pWHo
(индекс “о”
указывает, что
0). Значение
![]() отличается от истинного значения
кислотности раН
на величину
отличается от истинного значения
кислотности раН
на величину
![]() .
Последнюю обычно рассчитывают по
уравнению Дебая – Гюккеля при ионной
силе буферного раствора. Полученное
таким образом значение раН
является “инструментальной” величиной
рН и содержит некоторую ошибку, связанную
с невозможностью точного определения
коэффициента активности отдельного
сорта ионов.
.
Последнюю обычно рассчитывают по
уравнению Дебая – Гюккеля при ионной
силе буферного раствора. Полученное
таким образом значение раН
является “инструментальной” величиной
рН и содержит некоторую ошибку, связанную
с невозможностью точного определения
коэффициента активности отдельного
сорта ионов.
18.8.4. Определение произведения растворимости
Растворимость труднорастворимых солей в растворах других солей можно определить по измерениям ЭДС цепей без переноса. Например, для определения произведения растворимости AgCl можно использовать цепь типа
Ag | AgCl(тв.) |MCl(розчин) |Cl2 |Pt,
ЭДС которой
![]()
![]() , (18.107)
, (18.107)
где LAgCl – произведение растворимости AgCl.
В ряде случаев не удается подобрать электроды, обратимые к катионам и анионам труднорастворимой соли и тогда используются цепи с переносом, в которых в суммарном электрохимическом процессе участвует лишь один из ионов изучаемой соли. Для расчета L используется то или иное предположение о коэффициентах активности иона. Например, для определения LAgCl можно составить электрохимическую цепь
Ag AgCl KCl AgNO3 Ag,
для которой
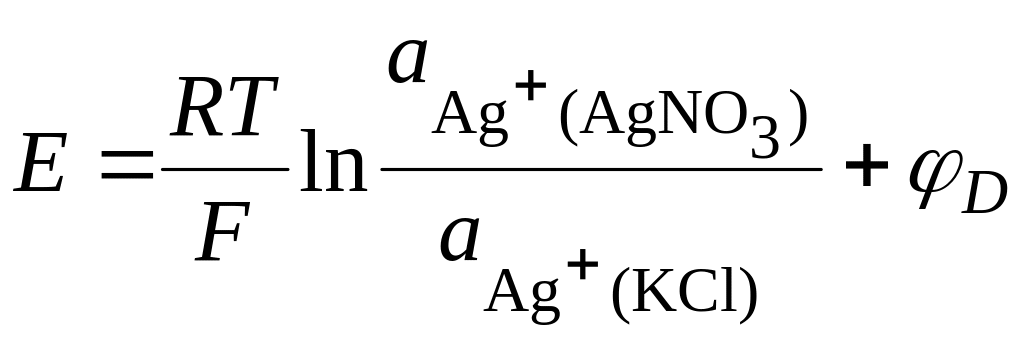 . (18.108)
. (18.108)
Активность ионов серебра в растворе хлорида калия выразим через произведение растворимости хлорида серебра:
![]() . (18.109)
. (18.109)
Если пренебречь диффузионным потенциалом, то
![]() . (18.110)
. (18.110)
Принимая, что коэффициенты активности ионов равны среднеионным коэффициентам активности солей, получим
![]() , (18.111)
, (18.111)
откуда и вычисляется произведение растворимости.
