
- •Глава 18. Электрохимические элементы
- •18.1. Электрохимические элементы. Электродвижущая сила
- •18.2. Термодинамика электрохимических элементов
- •18.3. Эдс как сумма скачков потенциалов
- •18.4. Двойной электрический слой
- •18.4.1. Электрокапиллярные явления
- •18.5. Электродные потенциалы
- •18.6.Типы электродов
- •18.6.1. Электроды первого рода
- •18.6.2. Электроды второго рода
- •18.6.3. Окислительно-восстановительные электроды
- •18.6.4. Мембранные электроды
- •Стеклянные электроды.
- •Другие ионоселективные электроды.
- •18.7. Типы электрохимических цепей
- •18.7.1.Химические цепи без переноса.
- •18.7.2. Концентрационные цепи без переноса
- •18.7.3. Химические цепи с переносом
- •18.7.4. Концентрационные цепи с переносом
- •18.7.5. Диффузионные потенциалы
- •18.8. Потенциометрия
- •18.8.1. Определение коэффициентов активности электролитов
- •18.8.2. Определение константы диссоциации слабой кислоты
- •18.8.3. Определение рН растворов
- •18.8.4. Определение произведения растворимости
- •18.8.5. Потенциометрическое титрование
18.6.Типы электродов
Как следует из уравнения Нернста, потенциал любого электрода при заданных температуре и давлении определяется стандартным потенциалом о и активностями веществ, принимающих участие в электродной реакции. Стандартный потенциал является константой, свойственной каждому данному электроду, в то время как активности участвующих в реакции веществ могут быть разными и зависеть от состава реакционной среды. Характер влияния активностей компонентов раствора на величину электродного потенциала непосредственно связан с природой электродной реакции. Как указывалось ранее, в электрохимии используют понятие обратимого электрода – электрода, на котором устанавливается равновесие между двумя противоположно направленными электродными реакциями, скорости которых достаточно высоки с практической точки зрения. В зависимости от устройства и характера электродного процесса различают несколько типов обратимых электродов. Наиболее распространенными типами электродов являются:
1. Электроды первого рода. К ним относятся катионные электроды, потенциал которых зависит от активности катионов. На таких электродах устанавливается равновесие между электронейтральными частицами (например, атомами металла) и соответствующими катионами в растворе – металлические (цинковый, медный, серебряный и т.д.), амальгамные (амальгамы щелочных и щелочноземельных металлов) электроды, газовый водородный электрод. На анионных электродах первого рода устанавливается равновесие между электронейтральными частицами и анионами – хлорный, бромный, йодный электроды.
2. Электроды второго рода. Эти электроды состоят из трех фаз – металла, его труднорастворимой соли и раствора, содержащего анионы этой соли. На этих электродах устанавливается равновесие между атомами металла и анионами в растворе как результат двух частных равновесий: между металлом и катионом труднорастворимой соли и между анионом в твердой фазе этой соли и анионом в растворе.
3. Окислительно-восстановительные электроды. Они составлены из индифферентного металла (обычно платина, иногда золото или палладий), погруженного в раствор, который содержит окисленную и восстановленную формы одного и того же вещества.
4. Ионоселективные электроды, на которых возникают мембранные потенциалы.
18.6.1. Электроды первого рода
Потенциал металлического катионного электрода Меz+|Ме зависит от активности ионов металла в растворе:
![]() , (18.31)
, (18.31)
где z+ – число электронов,
расходуемых на восстановление одного
иона металла, т.е. заряд иона в растворе.
В случае амальгамного электрода металл
растворен в ртути, поэтому может меняться
не только активность ионов металла в
растворе
![]() ,
но и активность металла в амальгаме
аМе. Потенциал амальгамного
электрода
,
но и активность металла в амальгаме
аМе. Потенциал амальгамного
электрода
![]() . (18.32)
. (18.32)
Если составной частью электрода является газ, сорбированный поверхностью металла, то такой электрод называют газовым, а его потенциал зависит также от давления газа. Наиболее важным для теории электродом первого рода является газовый водородный электрод, который, как указано выше, является стандартным электродом сравнения. Он представляет собою платиновую пластинку, покрытую платиновой чернью. Электрод насыщают затем тщательно очищенным и осушенным водородом. Платиновая чернь играет двоякую роль: с одной стороны, она катализирует равновесную реакцию на электроде Н2 L 2Н+, с другой – обеспечивает благодаря своей большой удельной поверхности присутствие значительных количеств водорода. На платине устанавливается равновесие между водородом и его ионами в растворе:
2Н+ + 2е L Н2
Так как стандартный потенциал водородного электрода принят равным нулю, то его потенциал
![]()
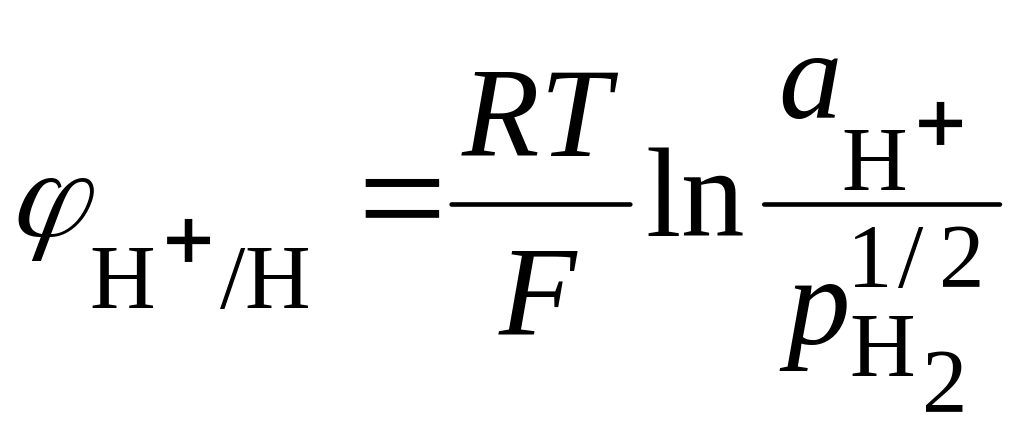 . (18.33)
. (18.33)
Потенциал анионного электрода первого рода выражается уравнением
![]() . (18.34)
. (18.34)
Если анионный электрод является газовым, то в уравнение для электродного потенциала включается также давление газа. Например, потенциал хлорного электрода Рt(Cl2)|Cl–
![]() . (18.35)
. (18.35)
Анионные электроды первого рода редко применяют на практике; гораздо удобнее использовать обратимые относительно анионов электроды второго рода.
