
- •Глава 18. Электрохимические элементы
- •18.1. Электрохимические элементы. Электродвижущая сила
- •18.2. Термодинамика электрохимических элементов
- •18.3. Эдс как сумма скачков потенциалов
- •18.4. Двойной электрический слой
- •18.4.1. Электрокапиллярные явления
- •18.5. Электродные потенциалы
- •18.6.Типы электродов
- •18.6.1. Электроды первого рода
- •18.6.2. Электроды второго рода
- •18.6.3. Окислительно-восстановительные электроды
- •18.6.4. Мембранные электроды
- •Стеклянные электроды.
- •Другие ионоселективные электроды.
- •18.7. Типы электрохимических цепей
- •18.7.1.Химические цепи без переноса.
- •18.7.2. Концентрационные цепи без переноса
- •18.7.3. Химические цепи с переносом
- •18.7.4. Концентрационные цепи с переносом
- •18.7.5. Диффузионные потенциалы
- •18.8. Потенциометрия
- •18.8.1. Определение коэффициентов активности электролитов
- •18.8.2. Определение константы диссоциации слабой кислоты
- •18.8.3. Определение рН растворов
- •18.8.4. Определение произведения растворимости
- •18.8.5. Потенциометрическое титрование
18.7.3. Химические цепи с переносом
В этих цепях два различных электрода погружены в различные растворы, а контакт между растворами осуществляется через какую-либо пористую мембрану или с помощью электролитического ключа (электролитического мостика) из насыщенного раствора KCl, KNO3, NH4Cl и др. Например, цепь
Pt | (H2) | HCl | KCl (насыщ. р-р) | KCl | AgCl | Ag, (VI)
или в сокращенной записи
Pt | (H2) | H+ || Cl– | AgCl | Ag,
отличается от приведенной выше химической цепи без переноса (I) тем, что водородный и хлорсеребряный электроды находятся в разных растворах. Поэтому уравнение для ЭДС этой цепи формально имеет такой же вид, как и для цепи без переноса с включением дополнительно диффузионного потенциала (в общем случае потенциала жидкостного соединения):
![]() . (18.84)
. (18.84)
Величиной диффузионного потенциала можно пренебречь при наличии электролитического мостика или считать его постоянным и включить в величину Ео, тогда
![]() . (18.85)
. (18.85)
В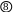 случае химических цепей с переносом
произведение активностей ионов нельзя
заменить средней ионной активностью
электролита, поскольку катионы и анионы
образуются при диссоциации разных
электролитов (в нашем примере HCl и KCl)
или же одного и того же электролита, но
разных концентраций (хлорсеребряный
электрод может также находиться в
растворе HCl, но другой концентрации или
в другом растворителе).
случае химических цепей с переносом
произведение активностей ионов нельзя
заменить средней ионной активностью
электролита, поскольку катионы и анионы
образуются при диссоциации разных
электролитов (в нашем примере HCl и KCl)
или же одного и того же электролита, но
разных концентраций (хлорсеребряный
электрод может также находиться в
растворе HCl, но другой концентрации или
в другом растворителе).
18.7.4. Концентрационные цепи с переносом
В таких цепях два одинаковых электрода находятся в растворах с одними и теми же потенциалопределяющими ионами, но с разной активностью (концентрацией). Примером может служить цепь с двумя серебряными электродами в растворах нитрата серебра разной концентрации:
Ag | AgNO3 (a1) || AgNO3 (a2) | Ag (VII)
При a1 < a2 на левом электроде происходит растворение серебра
Ag Ag+(I) + e,
а на правом – разряд ионов серебра и осаждение серебра на электроде:
Ag+(II) + e Ag
Таким образом, суммарный процесс формально можно представить как перенос ионов серебра из более концентрированного раствора (II) в менее концентрированный (I):
Ag+(II) Ag+(I)
Если не учитывать диффузионный потенциал, то ЭДС цепи
![]() . (18.86)
. (18.86)
18.7.5. Диффузионные потенциалы
В цепях с переносом на границе соприкосновения двух растворов возникает скачок потенциала, связанный с диффузией ионов соли в растворе против градиента концентрации. Между коэффициентом диффузии иона Di и его подвижностью Ui существует соотношение, впервые полученное Нернстом:
![]() . (18.87)
. (18.87)
Коэффициент диффузии соли D можно выразить через подвижности и коэффициенты диффузии ионов, на которые диссоциирует эта соль:
![]() . (18.88)
. (18.88)
Ионы с большей подвижностью диффундируют в более разбавленный раствор с большей скоростью, поэтому на границе соприкосновения разбавленный раствор приобретает заряд, соответствующий по знаку заряду диффундирующего иона, а более концентрированный раствор – заряд противоположного знака, т.е. образуется двойной электрический слой. Возникновение разности потенциалов на границе приводит к ускорению движения более медленного иона и замедлению более быстрого до тех пор, пока скорости движения ионов не уравняются. Наступает стационарное состояние, при котором растворенный электролит диффундирует как единое целое, а разность потенциалов на границе перестает изменяться – устанавливается диффузионный потенциал.
Поскольку стационарное состояние не является равновесным, а скачок потенциала возникает между точками, лежащими в двух разных фазах, строго термодинамически невозможно определить величину диффузионного потенциала. Термодинамический метод позволяет определить ЭДС концентрационного элемента в целом с включением диффузионного потенциала. Лишь в некоторых простейших случаях можно примерно оценить значение диффузионного потенциала.
Рассмотрим расчет значения диффузионного
потенциала на примере приведенной выше
концентрационной цепи с переносом
(VII). При прохождении через элемент F
кулонов электричества в левом полуэлементе
происходят следующие процессы: 1)
растворяется 1 эквивалент серебра; 2)
переходит слева направо t+
эквивалентов Ag+;
3) поступает справа t–
эквивалентов
![]() .
В результате в левом полуэлементе
появляется (1 – t+)
= t–
эквивалентов Ag+
и t–
эквивалентов
.
В правом полуэлементе 1) разряжается 1
эквивалент Ag+;
2) в полуэлемент поступает t+
эквивалентов Ag+
из левого полуэлемента; 3) уходит в левый
полуэлемент t– эквивалентов
.
В сумме в правом полуэлементе исчезает
по t–
эквивалентов тех и других ионов.
.
В результате в левом полуэлементе
появляется (1 – t+)
= t–
эквивалентов Ag+
и t–
эквивалентов
.
В правом полуэлементе 1) разряжается 1
эквивалент Ag+;
2) в полуэлемент поступает t+
эквивалентов Ag+
из левого полуэлемента; 3) уходит в левый
полуэлемент t– эквивалентов
.
В сумме в правом полуэлементе исчезает
по t–
эквивалентов тех и других ионов.
Таким образом, суммарный процесс в элементе состоит в переносе по t– эквивалентов двух ионов из раствора с большей активностью в раствор с меньшей активностью. Изменение энергии Гиббса в этом процессе
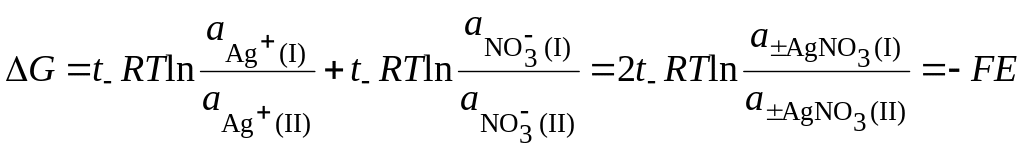 . (18.89)
. (18.89)
ЭДС элемента
![]() . (18.90)
. (18.90)
Это уравнение отличается от уравнения
(18.86) для ЭДС цепи, полученного без учета
диффузионного потенциала. Разность
этих ЭДС и дает величину диффузионного
потенциала D.
Если в уравнении (18.86) принять
![]() ,
то
,
то
![]() . (18.91)
. (18.91)
Отсюда видно, что если подвижность аниона больше подвижности катиона (V > U), то D > 0, т.е. диффузионный потенциал прибавляется к разности потенциалов электродов, в противном случае (V < U) D < 0. Если подвижности катиона и аниона близки (U V), то D 0. Это и используется для элиминирования (уменьшения) диффузионного потенциала с помощью солевых мостиков, состоящих из концентрированных растворов электролитов с близкими подвижностями катиона и аниона.
В другом частном случае – при контакте двух растворов одинаковой концентрации разных электролитов с общим ионом – диффузионный потенциал возникает вследствие различия в подвижностях разных ионов в двух растворах. Диффузионный потенциал на такой границе можно оценить по формуле:
![]() . (18.92)
. (18.92)
Более общая формула для диффузионных потенциалов в смешанных растворах, содержащих i сортов ионов, получена Гендерсоном:
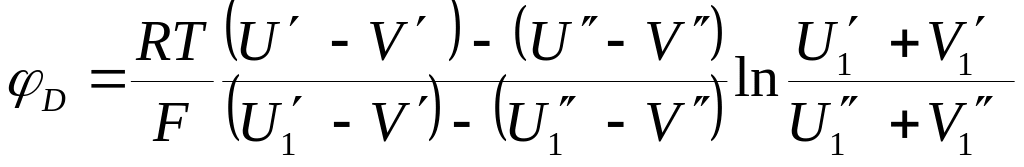 , (18.93)
, (18.93)
где для раствора ()
![]() ;
;
![]() ;
;
![]() ;
;
![]()
и такие же обозначения для раствора ().
Следует однако заметить, что расчет диффузионного потенциала по различным формулам может давать большие погрешности, поэтому на практике используется элиминирование диффузионного потенциала с помощью солевых мостиков, а для точных определений используются цепи без переноса.
