
- •Глава 18. Электрохимические элементы
- •18.1. Электрохимические элементы. Электродвижущая сила
- •18.2. Термодинамика электрохимических элементов
- •18.3. Эдс как сумма скачков потенциалов
- •18.4. Двойной электрический слой
- •18.4.1. Электрокапиллярные явления
- •18.5. Электродные потенциалы
- •18.6.Типы электродов
- •18.6.1. Электроды первого рода
- •18.6.2. Электроды второго рода
- •18.6.3. Окислительно-восстановительные электроды
- •18.6.4. Мембранные электроды
- •Стеклянные электроды.
- •Другие ионоселективные электроды.
- •18.7. Типы электрохимических цепей
- •18.7.1.Химические цепи без переноса.
- •18.7.2. Концентрационные цепи без переноса
- •18.7.3. Химические цепи с переносом
- •18.7.4. Концентрационные цепи с переносом
- •18.7.5. Диффузионные потенциалы
- •18.8. Потенциометрия
- •18.8.1. Определение коэффициентов активности электролитов
- •18.8.2. Определение константы диссоциации слабой кислоты
- •18.8.3. Определение рН растворов
- •18.8.4. Определение произведения растворимости
- •18.8.5. Потенциометрическое титрование
18.8. Потенциометрия
Потенциометрия – это методы, которые позволяют определять различные физико-химических величины и проводить количественный анализ на основании измерений ЭДС различных электрохимических элементов. Потенциометрически можно определять коэффициенты активности, константы равновесий различных химических реакций (в том числе константы диссоциации слабых электролитов, константы комплексообразования), произведения растворимости, рН, числа переноса ионов и т.д. В аналитической химии потенциометрию применяют для определения содержания ионов как прямым путем, так и при помощи потенциометрического титрования.
18.8.1. Определение коэффициентов активности электролитов
Для точного определения коэффициентов активности электролитов обычно используются химические цепи без переноса, один из электродов которых обратим по отношению к катионам, а другой – к анионам. В качестве примера рассмотрим определение коэффициентов активности HCl с помощью цепи (I), ЭДС которой (уравнение 18.78)
![]() .
(18.94)
.
(18.94)
Если хлороводород полностью диссоциирован
в растворе, можно заменить произведения
концентраций и коэффициентов активности
ионов на среднеионные величины. Тогда
с учетом того, что
![]() и для HCl
и для HCl
![]() ,
получим (опуская нижний индекс HCl):
,
получим (опуская нижний индекс HCl):
![]() . (18.95)
. (18.95)
Преобразуем это уравнение так, чтобы в левой части находились известные величины (концентрация растворов m и измеряемая ЭДС цепи Е):
![]() . (18.96)
. (18.96)
В правой части уравнения стоят неизвестные
величины стандартной ЭДС (постоянная
величина) и коэффициентов активности,
изменяющихся с концентрацией. В
разбавленных растворах для коэффициентов
активности справедливо уравнение Дебая
– Гюккеля
![]() ,
а так как для 1-1 зарядных электролитов
ионная сила I = m, то после
подстановки этих значений в уравнение
(18.96) получим
,
а так как для 1-1 зарядных электролитов
ионная сила I = m, то после
подстановки этих значений в уравнение
(18.96) получим
![]() . (18.97)
. (18.97)
Это уравнение прямой в координатах
![]() .
.
По данным измерений ЭДС цепи при разных концентрациях кислоты строят график зависимости . В области разбавленных растворов, где выполняется уравнение Дебая – Гюккеля, проводят прямую, экстраполяцией, которой на m = 0 получают стандартную ЭДС цепи Ео (рис. 18.9), а затем рассчитывают коэффициенты активности на основании уравнения (18.96):
![]() . (18.98)
. (18.98)
Рис. 18.9. Определение
стандартной ЭДС цепи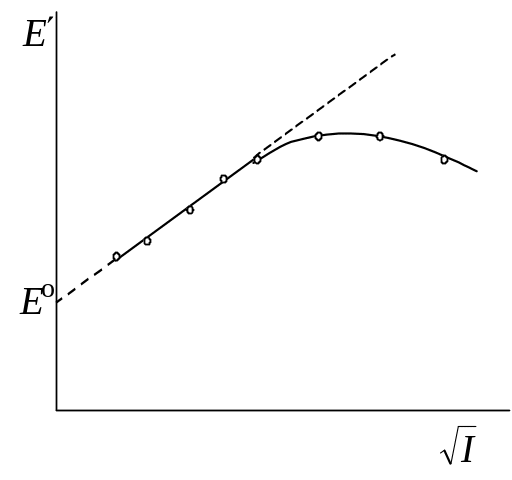
С помощью этого метода можно также изучать влияние добавок различных солей на коэффициенты активности изучаемого электролита. При этом во всех выше приведенных уравнениях вместо концентрации следует брать ионную силу раствора.
18.8.2. Определение константы диссоциации слабой кислоты
Для определения константы диссоциации слабой кислоты НА также можно использовать цепь без переноса с водородным (или стеклянным) и хлорсеребряным электродами в растворе этой кислоты с добавками хлорида МСl (например, КСl). Для поддержания постоянной концентрации ионов водорода в раствор вводят также соль слабой кислоты МА, т.е. используется буферный раствор:
![]()
ЭДС цепи описывается уравнением (18.94), но вследствие неполной диссоциации кислоты концентрация ионов водорода отличается от общей концентрации кислоты m1. Активность ионов водорода можно представить через константу диссоциации кислоты K:
![]() (18.99)
(18.99)
и подставить в уравнение (18.94):
![]()
![]() . (18.100)
. (18.100)
В случае полной диссоциации солей можно
считать, что практически mHA =
m1,
![]() .
Тогда
.
Тогда
![]() . (18.101)
. (18.101)
Стандартную ЭДС цепи Ео определяют по измерениям Е цепи с растворами сильной кислоты, как описано в предыдущем параграфе. Вначале рассчитывают величины рК при различных значениях концентрации кислоты и солей без учета последнего члена справа, а затем строят график зависимости полученных величин рК от ионной силы растворов. Так как при mi 0 i 0, то экстраполяцией на нулевую ионную силу получают значение термодинамической константы диссоциации.
