
- •Глава 18. Электрохимические элементы
- •18.1. Электрохимические элементы. Электродвижущая сила
- •18.2. Термодинамика электрохимических элементов
- •18.3. Эдс как сумма скачков потенциалов
- •18.4. Двойной электрический слой
- •18.4.1. Электрокапиллярные явления
- •18.5. Электродные потенциалы
- •18.6.Типы электродов
- •18.6.1. Электроды первого рода
- •18.6.2. Электроды второго рода
- •18.6.3. Окислительно-восстановительные электроды
- •18.6.4. Мембранные электроды
- •Стеклянные электроды.
- •Другие ионоселективные электроды.
- •18.7. Типы электрохимических цепей
- •18.7.1.Химические цепи без переноса.
- •18.7.2. Концентрационные цепи без переноса
- •18.7.3. Химические цепи с переносом
- •18.7.4. Концентрационные цепи с переносом
- •18.7.5. Диффузионные потенциалы
- •18.8. Потенциометрия
- •18.8.1. Определение коэффициентов активности электролитов
- •18.8.2. Определение константы диссоциации слабой кислоты
- •18.8.3. Определение рН растворов
- •18.8.4. Определение произведения растворимости
- •18.8.5. Потенциометрическое титрование
18.3. Эдс как сумма скачков потенциалов
Энергетическое состояние какой-либо заряженной частицы i внутри некоторой фазы характеризуется в общем случае суммой химического потенциала частицы и ее электрической энергией в данной фазе:
![]() . (18.12)
. (18.12)
В
6![]() называется электрохимическим
потенциалом частицы, а
– внутренним потенциалом, который
соответствует разности потенциалов
между точкой внутри фазы и бесконечно
удаленной точкой в вакууме. Работа
переноса заряженной частицы из фазы
в фазу равна
разности электрохимических потенциалов:
называется электрохимическим
потенциалом частицы, а
– внутренним потенциалом, который
соответствует разности потенциалов
между точкой внутри фазы и бесконечно
удаленной точкой в вакууме. Работа
переноса заряженной частицы из фазы
в фазу равна
разности электрохимических потенциалов:
![]() . (18.13)
. (18.13)
В условиях равновесия эта работа равна нулю, т.е. в равновесном состоянии электрохимические потенциалы частицы одинаковы во всех фазах.
Величину внутреннего потенциала можно представить в виде суммы двух потенциалов – внешнего и поверхностного :
= + . (18.14)
Внешний потенциал соответствует работе переноса элементарного отрицательного заряда из бесконечности в вакууме в точку также в вакууме, но в непосредственной близости к поверхности данной фазы. Поверхностный потенциал определяется работой переноса элементарного положительного заряда из глубины фазы в точку в вакууме в непосредственной близости к поверхности фазы. Само понятие “в непосредственной близости” не является достаточно строгим. Под ним обычно понимают то минимальное расстояние от поверхности фазы, на котором уже проявляются силы зеркального отображения; это расстояние порядка 10–8 м. Знак -потенциала совпадает со знаком заряда конца диполя, который лежит ближе к поверхности раздела фаз, т.е. с зарядом его внешнего конца.
Наличие поверхностного потенциала связано с существованием двойного электрического слоя (ДЭС) на границе фаз. На этой границе возможно перераспределение электрических зарядов и возникает межфазный, или пограничный, слой. Это происходит потому, что электрически заряженные частицы могут переходить из одной фазы в другую – электроны из металла в другую фазу; ионы из кристаллической решетки металла или соли в раствор или в обратном направлении; ионы из раствора в другую фазу и т.п. В результате каждая фаза приобретает электрический заряд разного знака, что и приводит к возникновению ДЭС. Различают четыре причины перераспределения зарядов на границе контактирующих фаз: 1) перенос заряда через границу фаз; 2) неэквивалентная адсорбция катионов и анионов; 3) адсорбция и ориентация дипольных молекул; 4) деформация и поляризация атомов и молекул в неоднородном силовом поле пограничного слоя. В реальных системах в пограничном слое одновременно могут наблюдаться несколько из перечисленных явлений в зависимости от природы фаз.
Так называемый реальный потенциал
![]() частицы i в фазе
одинаков по величине, но противоположен
по знаку работе выхода частицы из фазы
в вакуум
частицы i в фазе
одинаков по величине, но противоположен
по знаку работе выхода частицы из фазы
в вакуум
![]() :
:
![]() . (18.15)
. (18.15)
Соотношения между различными потенциалами выражаются также уравнениями:
![]() ; (18.16)
; (18.16)
![]() . (18.17)
. (18.17)
Если одна фаза граничит с другой фазой , возникает необходимость учета разности внутренних потенциалов фаз на их границе раздела:
![]() . (18.18)
. (18.18)
Эта разность называется гальвани-потенциалом. Наряду с внешним скачком потенциала надо учитывать разность внешних потенциалов открытой части поверхности фаз после частичного (не по всей поверхности) контакта между ними. Эта разность потенциалов называется контактным, или вольта-потенциалом:
![]() . (18.19)
. (18.19)
В электрохимической системе возникает несколько скачков потенциалов, механизм образования которых зависит от природы фаз. Такими фазами являются: 1)твердые металлические фазы – оба электрода и внешняя цепь; 2) жидкие фазы – один или два раствора, прилегающие к электродам; 3) газовая фаза, граничащая с растворами и электродами (ее часто рассматривают по свойствам близкой к вакууму).
Как сказано выше, разность потенциалов между двумя точками определяется работой, которую нужно совершить, чтобы перенести элементарный электрический заряд из одной точки в другую. Если обе точки лежат в одной и той же фазе, то совершается только электрическая работа и разность потенциалов между выбранными точками можно определить или вычислить (вольта-потенциал). При переносе заряда из одной фазы в другую одновременно совершается химическая и электрическая работы (электрический заряд невозможно отделить от его носителя – электрона, иона) и можно определить лишь общий энергетический эффект, соответствующий электрохимическому потенциалу, а не его отдельные составляющие. Таким образом, определить экспериментально или рассчитать без каких-либо допущений абсолютную разность электрических потенциалов между двумя фазами (гальвани-потенциал) не удается. В то же время ЭДС электрохимической системы Е можно измерить непосредственно. Следовательно, она должна соответствовать разности потенциалов между двумя точками, лежащими в одной и той же фазе. Такими точками могут быть точки a и p, расположенные в одном и том же металле М2, или точки b и o , находящиеся в вакууме вблизи поверхности металла (см. рис. 18.1).
Рис. 18.1. Схема
электрохимической системы со скачками
потенциалов.
(М1
и М2
– металлы, L1
и L2
– растворы, 0 – газовая фаза)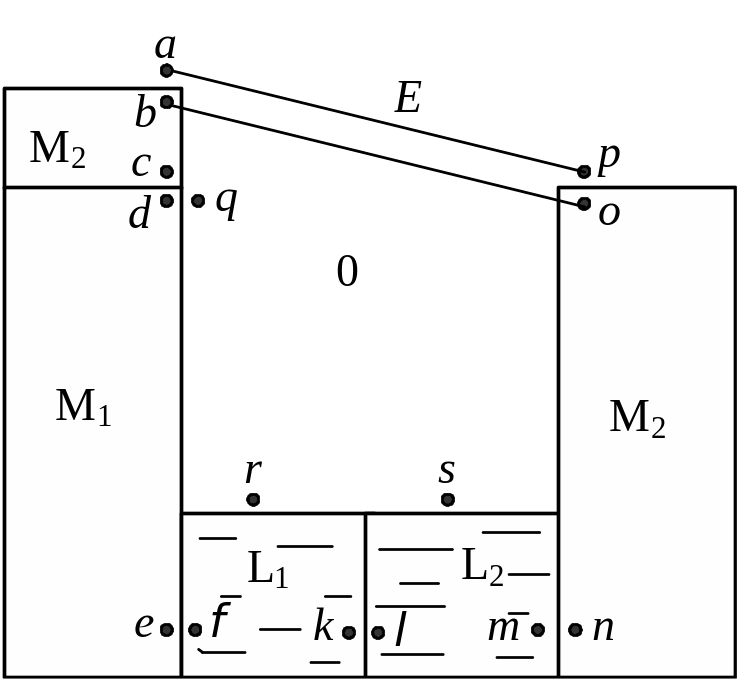
Скачки потенциалов между точками a–b
и o–p
являются поверхностными потенциалами![]() и
и![]() между металлом М2 и вакуумом 0,
равные по абсолютной величине и
противоположные по знаку (
=
–
).
Скачок потенциала между точками с –
d, находящимися в металлических фазах
М2 и М1, представляет собой
разность внутренних потенциалов
между металлом М2 и вакуумом 0,
равные по абсолютной величине и
противоположные по знаку (
=
–
).
Скачок потенциала между точками с –
d, находящимися в металлических фазах
М2 и М1, представляет собой
разность внутренних потенциалов
![]() .
Между точками e – f и m
– n возникают скачки
внутренних потенциалов между металлами
М и растворами L –
.
Между точками e – f и m
– n возникают скачки
внутренних потенциалов между металлами
М и растворами L –
![]() и
и
![]() (эти потенциалы часто называют потенциалами
Нернста). Разность потенциалов между
точками a –
q представляет
собой вольта-потенциал между двумя
металлами
(эти потенциалы часто называют потенциалами
Нернста). Разность потенциалов между
точками a –
q представляет
собой вольта-потенциал между двумя
металлами
![]() ,
а между точками q
– r
– вольта-потенциал между металлом и
раствором
,
а между точками q
– r
– вольта-потенциал между металлом и
раствором
![]() .
.
При наличии двух растворов L1 и L2
возникает также скачок потенциала на
границе этих растворов k
– l – гальвани-потенциал
![]() ,
который в случае разных растворителей
называют фазовым жидкостным потенциалом.
Если же растворы отличаются по природе
или концентрации электролита, но имеют
один и тот же растворитель, то этот
потенциал называют диффузионным
(часто его обозначают как d).
,
который в случае разных растворителей
называют фазовым жидкостным потенциалом.
Если же растворы отличаются по природе
или концентрации электролита, но имеют
один и тот же растворитель, то этот
потенциал называют диффузионным
(часто его обозначают как d).
Таким образом, ЭДС электрохимического элемента является суммой скачков потенциалов:
![]() . (18.20)
. (18.20)
После сокращения одинаковых слагаемых с учетом их знаков получим
![]() . (18.21)
. (18.21)
Отсюда следует, что ЭДС электрохимической системы складывается из четырех скачков потенциала: гальвани-потенциалов между двумя металлами и двумя растворами и двух нернстовских потенциалов. В тех случаях, когда электроды находятся в одном и том же растворе или диффузионный потенциал элиминирован, ЭДС можно представить в виде суммы трех гальвани-потенциалов:
![]() . (18.22)
. (18.22)
Полученное уравнение не дает возможности расчета ЭДС, которая выражается через гальвани-потенциалы, не поддающиеся измерению. Для равновесных электрохимических систем эту неопределенность можно преодолеть, исходя из того, что в обратимых процессах изменение энергии системы определяется начальным и конечным состояниями и не зависит от пути перехода. На этом основании непосредственные контакты между фазами, образующими систему, можно заменить их контактами через вакуум (рис. 18.2). Если электрохимический элемент содержит лишь один раствор L, то его ЭДС выражается суммой скачков потенциалов:
![]() ,
(18.23)
,
(18.23)
где индексы 0, 1, 2 и L обозначают вакуум,
металлы М1, М2 и раствор
соответственно. Учитывая, что для любых
скачков потенциала выполняется
соотношение типа
![]() ,
получим:
,
получим:
Рис. 18.2. ЭДС
электрохимической системы как сумма
вольта-потенциалов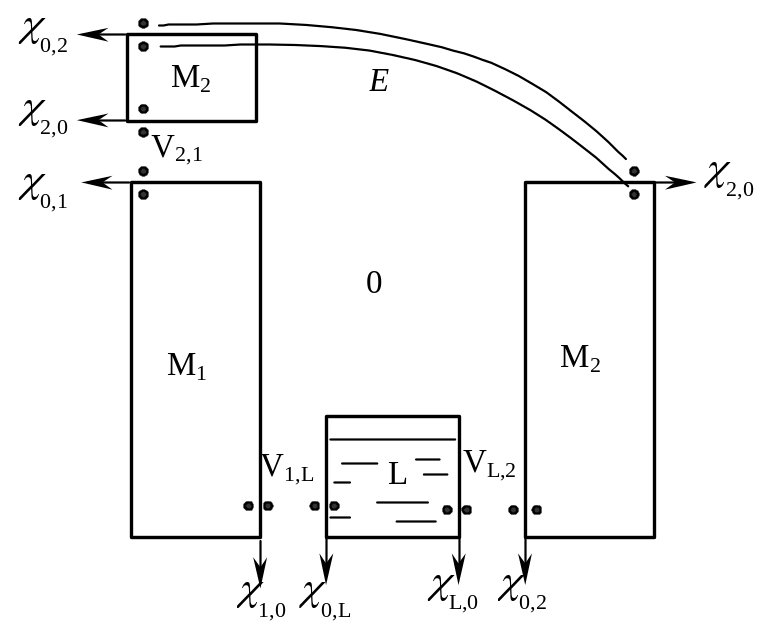
![]() . (18.24)
. (18.24)
Если система содержит два раствора, в уравнение войдет также величина жидкостного или диффузионного потенциалов.
Измеряемая величина ЭДС может быть
представлена и как разность внутренних
потенциалов точек, находящихся в двух
кусках одного и того же металла,
присоединенных к электродам
электрохимической системы (точки b
и o в кусках металла
М2 и
![]() на рис. 18.1):
на рис. 18.1):
![]() .
(18.25)
.
(18.25)
Как уже отмечалось ранее, разность внутренних потенциалов в общем случае является неопределенной величиной. В рассматриваемом случае М2 и имеют одинаковый химический состав (это один и тот же металл), поэтому их химические потенциалы равны, и на основании уравнения (18.5) можно получить:
![]() , (18.26)
, (18.26)
т.е. ЭДС представляет собой разность электрохимических потенциалов заряженной частицы в М2 и , доступную для непосредственного измерения.
