- •Л.В. Яковенко Оглавление
- •1. Цель работы
- •2. Теоретическая часть
- •2.1 Растворы
- •2.2. Сольватация
- •2.3. Классификация растворов
- •2.4. Электролиты. Электролитическая диссоциация
- •2.5. Ионные равновесия в водных растворах
- •2.5.1. Кислоты и основания
- •2.5.2. Сила кислот и оснований
- •2.6. Понятие pH
- •2.7. Буферные растворы
- •2.8. Активности ионов в растворе
- •2.9. Границы раздела фаз. Электроды
- •2.10. Потенциал полуэлемента. Уравнение Нернста
- •2.11. Диффузионный потенциал
- •Числа переноса
- •2.12. Классификация электродов
- •2.12.1. Водородный электрод
- •2.12.2. Хлорсеребряный и кáломельный электроды
- •2.12.3. Сурьмяный электрод
- •2.12.4. Стеклянный электрод
- •3. Экспериментальная часть в лаборатории
- •Задания
- •Порядок работы:
- •Определение рН буферных растворов
- •Определение буферной емкости
- •4. Контрольные вопросы
- •5. Литература
- •6. Приложения Правила техники безопасности
- •Пример расчета рН буферного раствора
- •Пример. Селективность стеклянного электрода
- •Кривая титрования 0,1 м р-ра серной кислоты 0,1 м р-ром NaOh
2.12.2. Хлорсеребряный и кáломельный электроды
Хлорсеребряный и кáломельный электроды относятся к электродам второго рода. В общем случае электродная реакция может быть записана в виде:
![]() ,
где
ν+
и ν–
– стехиометрические коэффициенты, z+
и z–
– валентности иона металла М
и аниона А,
ν+z+
+ ν–z–
= 0 (электронейтральность), n
= ν+z+
= ν–|z–|.
Соль – окисленная форма соединения,
ион металла и анион – восстановленная.
Через границу металл–соль могут
проходить только ионы металла, поэтому
потенциал металла будет определяться
активностью его ионов
,
где
ν+
и ν–
– стехиометрические коэффициенты, z+
и z–
– валентности иона металла М
и аниона А,
ν+z+
+ ν–z–
= 0 (электронейтральность), n
= ν+z+
= ν–|z–|.
Соль – окисленная форма соединения,
ион металла и анион – восстановленная.
Через границу металл–соль могут
проходить только ионы металла, поэтому
потенциал металла будет определяться
активностью его ионов
![]() ,
химический потенциал которых должен
быть одним и тем же в металле, соли и
растворе. Уравнение Нернста в этом
случае имеет вид:
,
химический потенциал которых должен
быть одним и тем же в металле, соли и
растворе. Уравнение Нернста в этом
случае имеет вид:
![]() .
.
Так как соль малорастворима, для нее выполняется соотношение
![]() ,
где
Ls
= const. –
произведение растворимости соли. Выразив
активность ионов металла из этого
выражения
,
где
Ls
= const. –
произведение растворимости соли. Выразив
активность ионов металла из этого
выражения

и подставив в уравнение Нернста, получим:
![]() ,
где
учтено условие электронейтральности,
а
,
где
учтено условие электронейтральности,
а
![]() .
Таким образом, потенциал электрода
второго рода определяется активностью
аниона в растворе.
.
Таким образом, потенциал электрода
второго рода определяется активностью
аниона в растворе.
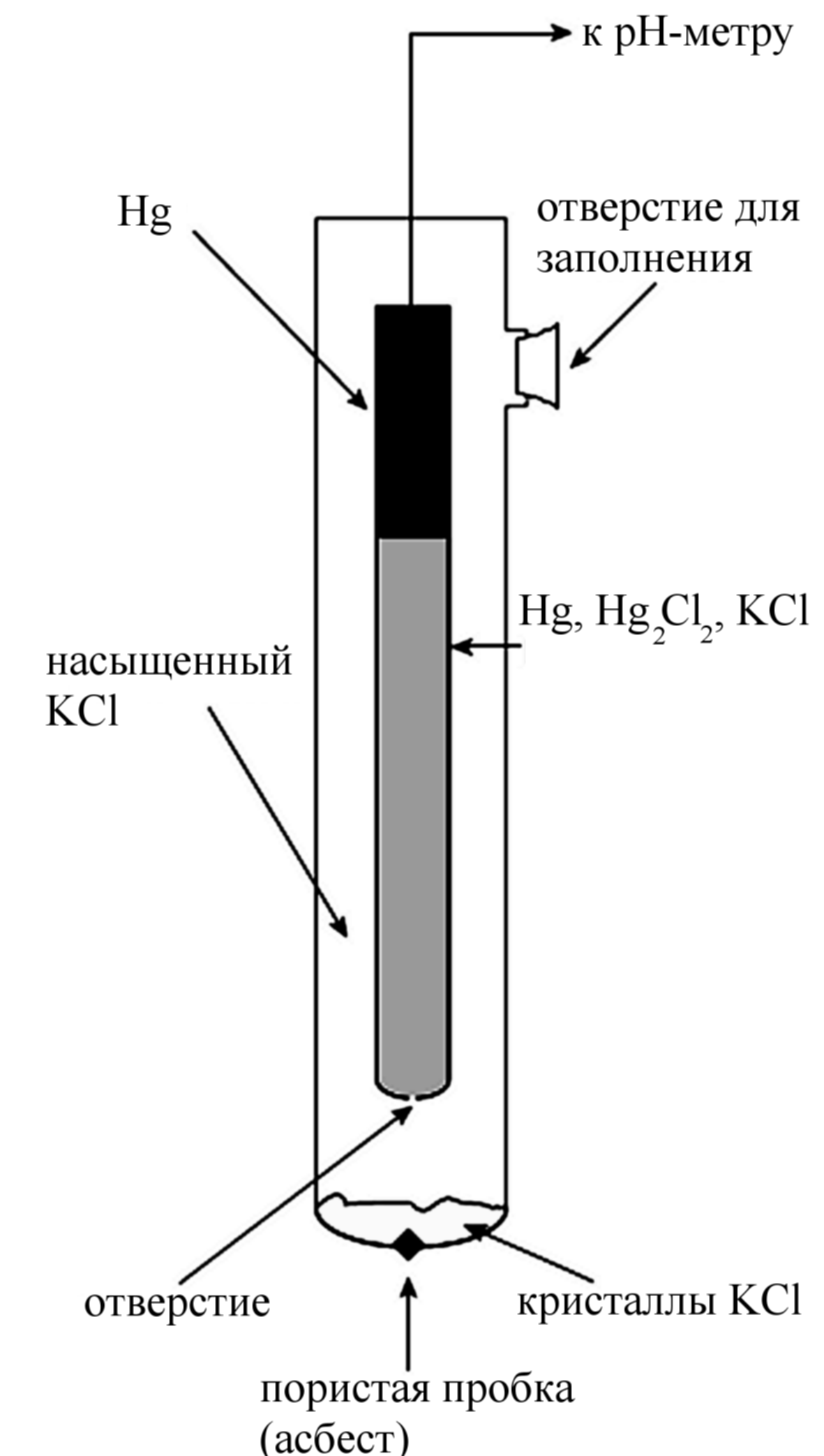
Устройство каломельного электрода (насыщенного) ясно из рисунка. Электродная реакция имеет вид:
|
|
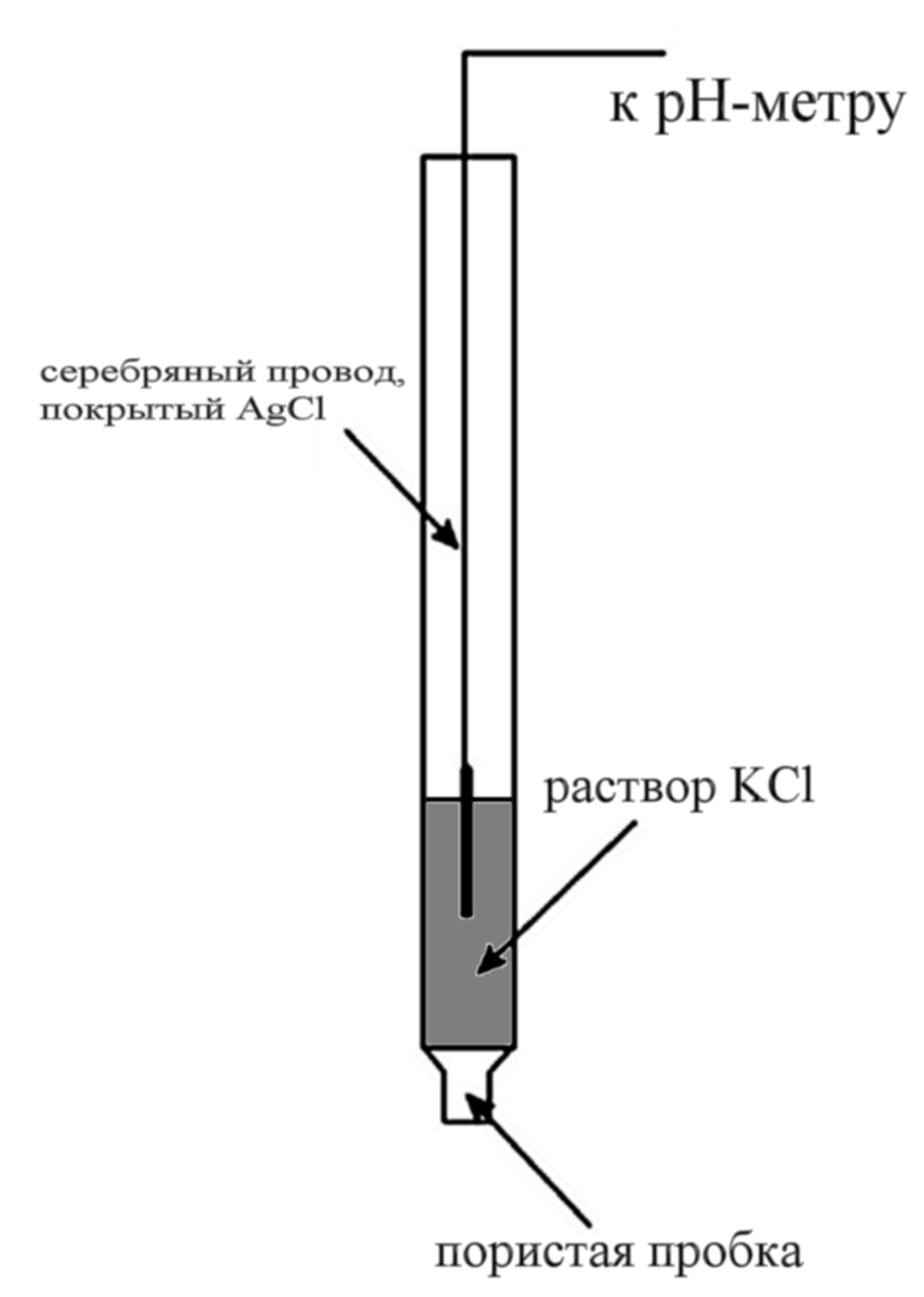
Хлорсеребряный электрод устроен сходным образом: серебряная проволочка, покрытая слоем малорастворимой соли хлорида серебра, погружена в раствор хлорида калия с известной активностью (обычно используется насыщенный раствор). Для хлорсеребряного электрода реакция имеет вид:
|
|
Уравнение Нернста для обоих электродов записывается одинаково:
![]() .
.
Таким образом, для насыщенного каломельного электрода при 298 К потенциал относительно стандартного водородного электрода равен 0, 2444 В, а для насыщенного хлорсеребряного электрода E = 0,197 В.
2.12.3. Сурьмяный электрод
Сурьмяный электрод представляет собой сурьмяную проволочку, впаянную в стеклянный капилляр. Его используют для измерения рН в малых объемах. Электродная реакция имеет вид:
2Sb + 6OH– – 6e– ↔ Sb2O3 + 3H2O.
Равновесный потенциал (в вольтах) такого электрода (при 298 К) равен
ESb = 0,64 – 0,059pH.
2.12.4. Стеклянный электрод
В 1906 г. Кремер обнаружил, что между сторонами тонкой стеклянной пластинки, разделяющей два раствора, возникает разность потенциалов, если концентрации H3O+ в растворах различны. Это наблюдение позволило Ф.Габеру создать в 1909 г. стеклянный электрод для измерения рН.
Стеклянный электрод относится
к ионоселективным электродам: стекло
ведет себя как катионообменник: внутри
стекла имеются неподвижные отрицательно
заряженные группы (например, кремниевой
кислоты), с которыми связаны относительно
подвижные катионы. Число центров
связывания считается фиксированным и
называется ионообменной емкостью
системы C,
при этом
![]() ,
где индекс m
относится к ионам в стекле.. Разные
катионы обладают разным сродством к
центрам связывания и разной подвижностью
в стекле. Если в стекле присутствуют
подввижные ионы Na+
и H+,
на обеих границах мембраны с растворами,
также содержащими эти ионы, идут
ионообменные реакции
,
где индекс m
относится к ионам в стекле.. Разные
катионы обладают разным сродством к
центрам связывания и разной подвижностью
в стекле. Если в стекле присутствуют
подввижные ионы Na+
и H+,
на обеих границах мембраны с растворами,
также содержащими эти ионы, идут
ионообменные реакции
![]() где символы без индекса относятся
к ионам в в растворе. Константа равновесия
для этой реакции называется константой
селективности ионообменника:
где символы без индекса относятся
к ионам в в растворе. Константа равновесия
для этой реакции называется константой
селективности ионообменника:
|
|
В идеальном случае мембрана должна была бы быть проницаемой только для одного типа ионов в присутствии других ионов.
Краткая запись для системы мембрана–растворы имеет вид:
Раствор 1 | Мембрана | Раствор 2.
Разность потенциалов между двумя растворами равна сумме двух гальвани-потенциалов на каждой границе раздела фаз и диффузионного потенциала внутри мембраны:
![]() ,
где
индексы 1 и 2 относятся к фазам 1-го и 2-го
растворов, соответственно. Если один
из растворов, например, 2-й, выбран
стандартным (индекс s),
то соответствующая разность потенциалов
станет стандартной (–Δφ°):
,
где
индексы 1 и 2 относятся к фазам 1-го и 2-го
растворов, соответственно. Если один
из растворов, например, 2-й, выбран
стандартным (индекс s),
то соответствующая разность потенциалов
станет стандартной (–Δφ°):
![]() .
.
Ионообменные процессы протекают быстро, поэтому можно считать, что на границах мембрана-раствор устанавливается равновесие. Тогда из равенства электрохимических потенциалов ионов в 1-м растворе и в мембране, получим
![]() ,
откуда, учитывая, что
,
откуда, учитывая, что
![]() ,
имеем:
,
имеем:
![]() .
.
В случае, когда в мембране
присутствуют два подвижных иона,
например, А+
и В+,
необходимо учитывать ионный обмен:
![]() .
Для упрощения записи будем обозначать
активности компонентов их символами в
записи уравнения реакции, например,
.
Для упрощения записи будем обозначать
активности компонентов их символами в
записи уравнения реакции, например,
![]() .
Тогда, используя константу равновесия
указанной реакции, получим
.
Тогда, используя константу равновесия
указанной реакции, получим
![]() ,
,
 ,
следовательно
,
следовательно
![]() .
.
Для гальвани-потенциала на границе мембраны с раствором 1 тогда получаем:
![]() .
.
Для оценки диффузионного потенциала будем пока считать, что оба иона присутствуют в обоих растворах (при измерении концентрации Az+ в стандартном растворе не должно быть ионов Bz+). Из ионообменных равновесий награницах мембраны следует:
![]() ,
где
Am,i
и Bm,i
– концентрации ионов на границе мембраны
с i-м
раствором. Тогда из общей формулы для
диффузионного потенциала ионов получим:
,
где
Am,i
и Bm,i
– концентрации ионов на границе мембраны
с i-м
раствором. Тогда из общей формулы для
диффузионного потенциала ионов получим:
![]() где
где
![]() ,
а uA
и uB
– подвижности ионов в мембране (считаем
их постоянными). Теперь положим B2
= 0. Тогда
,
а uA
и uB
– подвижности ионов в мембране (считаем
их постоянными). Теперь положим B2
= 0. Тогда
![]()
Подставив полученные выражения в уравнение для потенциала раствора 1 относительно стандартного раствора, получим уравнение Никольского:
![]() .
.
Величина KAB определяет селективность А-электрода по отношению к иону В, и для хорошего электрода должно выполняться неравенство KAB << 1.
Если стеклянный электрод поместить в стандартный раствор, то его потенциал не обратится в нуль. Этот остаточный потенциал называется потенциалом асимметрии. Он обусловлен различием свойств наружной и внутренней поверхностей стеклянного электрода, возникающим при изготовлении электрода. Потенциал асимметрии является характеристикой электрода и входит в его стандартный потенциал.
При потенциометрическом определении активности какого-либо компонента раствора этот раствор с измерительным электродом образует один полуэлемент, а электрод сравнения – второй. Электрод сравнения в растворе постоянного состава имеет постоянный потенциал, а потенциал измерительного (индикаторного) электрода линейно зависит от логарифма активности соответствующего компонента. По договоренности электрод сравнения принято считать анодом. Краткая запись потенциометрической ячейки выглядит следующим образом:
Электрод сравнения (reference) || Измерительный электрод (indicator)
В соответствии с принятыми обозначениями двумя параллельными линиями обозначается жидкостное соединение (солевой мостик), для которого характерно наличие разности потенциалов на каждой границе с другими растворами. Поэтому разность потенциалов ячейки должна быть записана так:
E = Ei – Er + Elj, где Elj – потенциал жидкостного соединения (диффузионный потенциал). В идеальном случае у электрода сравнения потенциал должен быть постоянным, так чтобы все изменения измеряемой разности потенциалов были обусловлены только изменениями потенциала измерительного электрода, т.е. изменениями концентрации анализируемого раствора.
Различные стеклянные электроды используют для измерения рН в разных диапазонах. Обычный (с Na2O) стеклянный электрод имеет хорошую избирательность при 0,5<рН<9. При больших рН электрод имеет заметную чувствительность к другим катионам, например, Na+ и K+.
Для потенциала стеклянного электрода в рабочей области при 25 °С можно использовать уравнение вида:
E = E0 – 0,05916 рН.
Для точного измерения потенциала электрода необходимо использование вольтметра с очень высоким входным сопротивлением (1012 Ом и более).
«Абсолютные» значения pH нельзя определить из-за невозможности определения коэффициентов активности отдельных ионов и наличия диффузионных скачков потенциала. Экспериментально определяются так называемые «инструментальные» величины pH с использованием колориметрического, кондуктометрического или потенциометрического методов. Разработаны методы определения pH с достаточно высокой точностью, в частности по измерениям в цепях без жидкостного соединения, которые используются для определения pH стандартных буферных растворов.
Примеры стандартных (эталонных) буферных растворов:
-
Состав и моляльные концентрации (моль/кг H2O) растворов
рН (298 К)
Тетраоксалат калия, KH3(C2H4)2∙2H2O (0,05)
1,68
Битартрат калия (насыщенный)
3,56
Бифталат калия (0,05)
4,01
KH2PO4 (0,025) + Na2HPO4 (0,025)
6,86
Натрий тетраборнокислый (бура) (0,01)
9,18

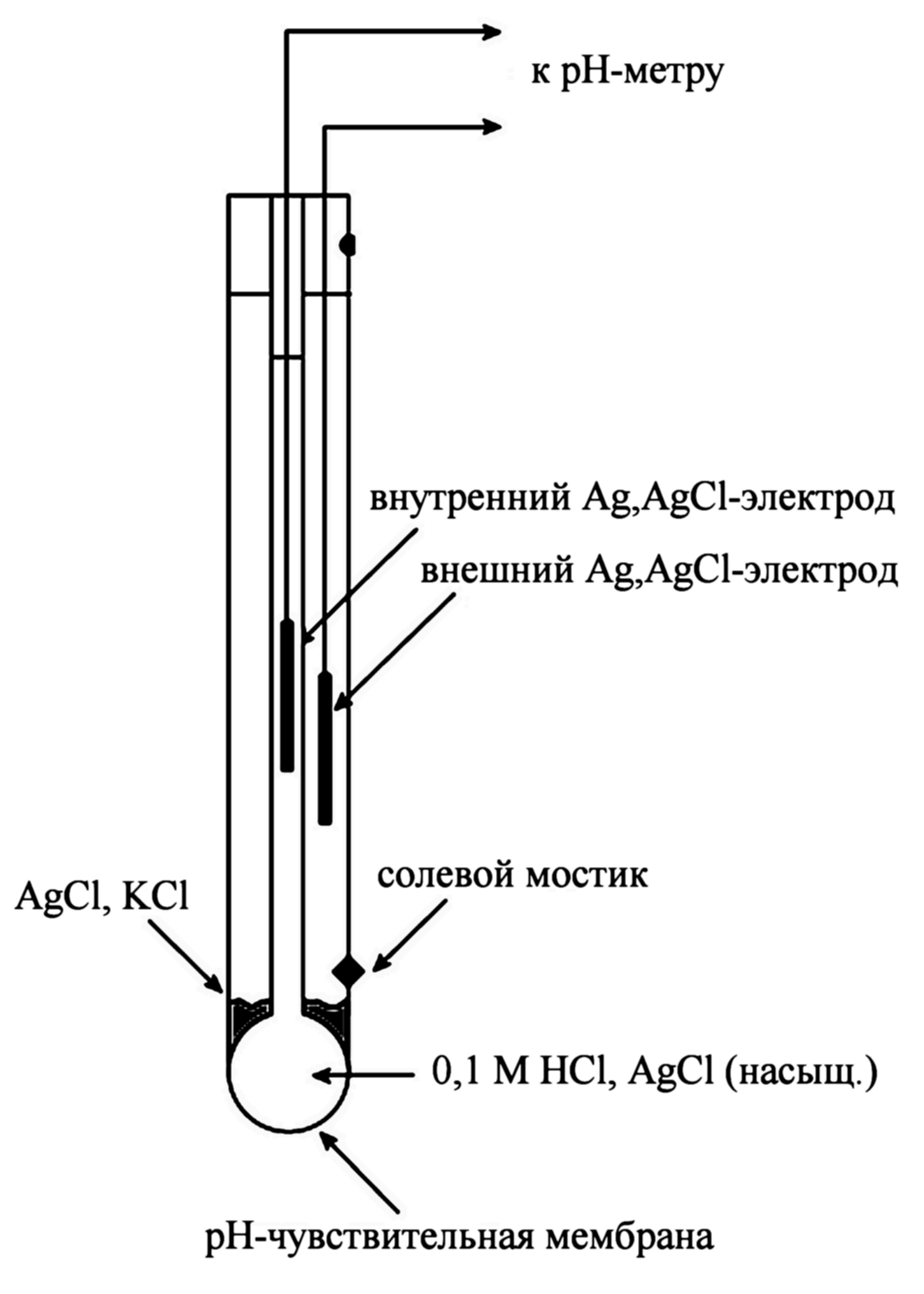
 Исходно
стеклянный электрод представлял собой
тонкостенный стеклянный шарик,
заполненный неким стандартным
раствором, в который был погружен
электрод сравнения. Для измерения рН
раствора использовали два электрода:
стеклянный и внешний электрод сравнения.
Позже стали использовать так называемые
комбинированные электроды, которые
в одном корпусе содержали и стеклянный
электрод и внешний электрод сравнения.
Схематически устройство такого
электрода приведено на рисунке.
Исходно
стеклянный электрод представлял собой
тонкостенный стеклянный шарик,
заполненный неким стандартным
раствором, в который был погружен
электрод сравнения. Для измерения рН
раствора использовали два электрода:
стеклянный и внешний электрод сравнения.
Позже стали использовать так называемые
комбинированные электроды, которые
в одном корпусе содержали и стеклянный
электрод и внешний электрод сравнения.
Схематически устройство такого
электрода приведено на рисунке.