
- •Л.В. Яковенко Оглавление
- •1. Цель работы
- •2. Теоретическая часть
- •2.1 Растворы
- •2.2. Сольватация
- •2.3. Классификация растворов
- •2.4. Электролиты. Электролитическая диссоциация
- •2.5. Ионные равновесия в водных растворах
- •2.5.1. Кислоты и основания
- •2.5.2. Сила кислот и оснований
- •2.6. Понятие pH
- •2.7. Буферные растворы
- •2.8. Активности ионов в растворе
- •2.9. Границы раздела фаз. Электроды
- •2.10. Потенциал полуэлемента. Уравнение Нернста
- •2.11. Диффузионный потенциал
- •Числа переноса
- •2.12. Классификация электродов
- •2.12.1. Водородный электрод
- •2.12.2. Хлорсеребряный и кáломельный электроды
- •2.12.3. Сурьмяный электрод
- •2.12.4. Стеклянный электрод
- •3. Экспериментальная часть в лаборатории
- •Задания
- •Порядок работы:
- •Определение рН буферных растворов
- •Определение буферной емкости
- •4. Контрольные вопросы
- •5. Литература
- •6. Приложения Правила техники безопасности
- •Пример расчета рН буферного раствора
- •Пример. Селективность стеклянного электрода
- •Кривая титрования 0,1 м р-ра серной кислоты 0,1 м р-ром NaOh
Задача 1. Базовые понятия для работы в биохимической лаборатории: шкала pH, буферные растворы.
Л.В. Яковенко Оглавление
1. Цель работы………………………………………………………………………..2
2. Теоретическая часть……………………………………………………………...2
2.1 Растворы……………………………………………………………………2
2.2. Сольватация………………………………………………………………3
2.3. Классификация растворов………………………………………………4
2.4. Электролиты. Электролитическая диссоциация…………………….5
2.5. Ионные равновесия в водных растворах……………………………...6
2.5.1. Кислоты и основания…………………………………………...6
2.5.2. Сила кислот и оснований………………………………………7
2.6. Понятие pH………………………………………………………………..8
2.7. Буферные растворы…………………………………………………….11
2.8. Активности ионов в растворе…………………………………………12
2.9. Границы раздела фаз. Электроды…………………………………….14
2.10. Потенциал полуэлемента. Уравнение Нернста……………………15
2.11. Диффузионный потенциал…………………………………………...16
2.12. Классификация электродов…………………………………………..18
2.12.1. Водородный электрод………………………………………...18
2.12.2. Хлорсеребряный и кáломельный электроды……………..19
2.12.3. Сурьмяный электрод…………………………………………20
2.12.4. Стеклянный электрод………………………………………..21
3. Экспериментальная часть……………………………………………………...23
4. Контрольные вопросы…………………………………………………………..25
5. Литература………………………………………………………………………..26
6. Приложения………………………………………………………………………26
1. Цель работы
Цель данной задачи практикума заключается в ознакомлении студентов с базовыми понятиями, необходимыми для работы в биофизической и биохимической лабораториях, - ионным произведением воды, величиной pH, диссоциацией кислот, титрованием кислот, буферными системами.
При подготовке к выполнению задачи практикума надо заранее рассчитать:
– кривую титрования 0,1 М раствора серной кислоты эквимолярным раствором гидроксида натрия.
2. Теоретическая часть
2.1 Растворы
Раствором называется гомогенная система (или фаза), состав которой может непрерывно изменяться в некоторых пределах. Растворы бывают жидкие, твердые и газообразные, но здесь мы ограничимся только жидкими растворами. Раствор представляет собой смесь частиц разных сортов, между которыми могут идти химические реакции, приводящие к изменению состава и химических потенциалов компонентов, однако этот случай мы здесь рассматривать также не будем.
Важнейшими характеристиками раствора являются его состав (перечень составляющих веществ) и концентрации компонентов. Один из компонентов раствора, обычно тот, что имеется в избытке, называется растворителем, а остальные компоненты – растворенными веществами. Выбор растворителя условен. При перечислении компонентов раствора растворителю обычно приписывают наименьший индекс (0 или 1).
Наиболее распространены следующие способы выражения концентраций.
Молярность (ci) – количество i-го компонента в молях (ni), содержащееся в 1 л объема системы (полный объем системы V выражен в литрах или дм3):
![]()
Размерность молярности имеет специальное обозначение: 1 моль/л = 1 М.
Моляльность (mi) – количество i-го компонента в молях (ni), приходящееся на 1000 г растворителя (g1 – масса растворителя, выраженная в граммах):
![]() .
.
Мольная доля (xi) – отношение числа молей компонента (ni) к общему числу молей в растворе:
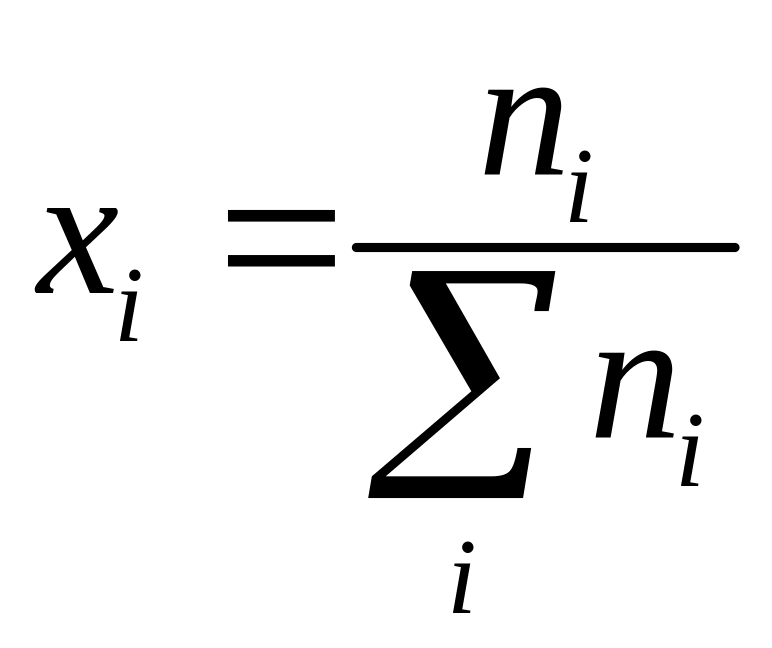 .
Мольным
содержанием называют мольную долю,
выраженную в процентах.
.
Мольным
содержанием называют мольную долю,
выраженную в процентах.
Массовая доля (wi) – отношение массы компонента (gi) к общей массе раствора:
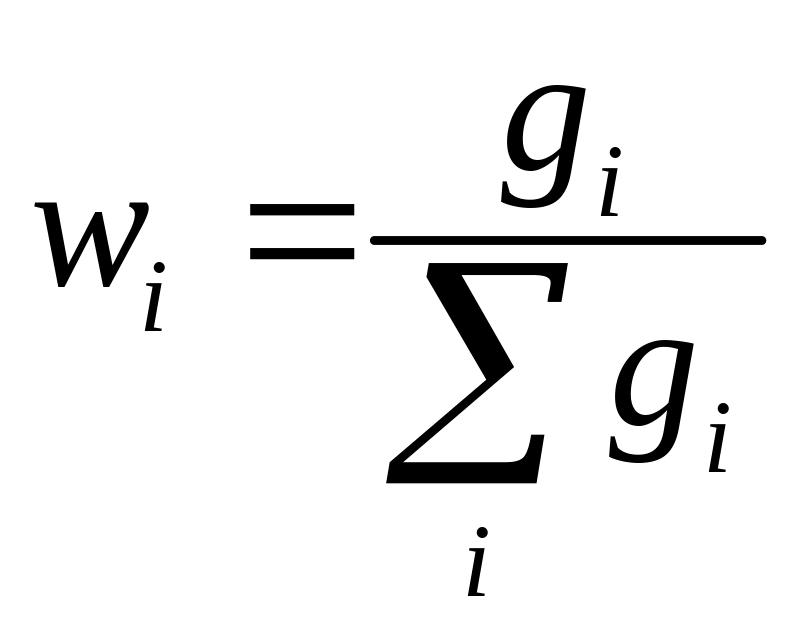 Массовым
содержанием называют массовую долю,
выраженную в процентах.
Массовым
содержанием называют массовую долю,
выраженную в процентах.
В лабораторной практике чаще всего используют молярные концентрации. При рассмотрении теоретических вопросов в физической химии удобнее использовать моляльные концентрации и мольные доли, поскольку в этом случае концентрация не зависит от температуры. Для пересчета одних концентраций в другие можно использовать следующие соотношения:
 ,
,
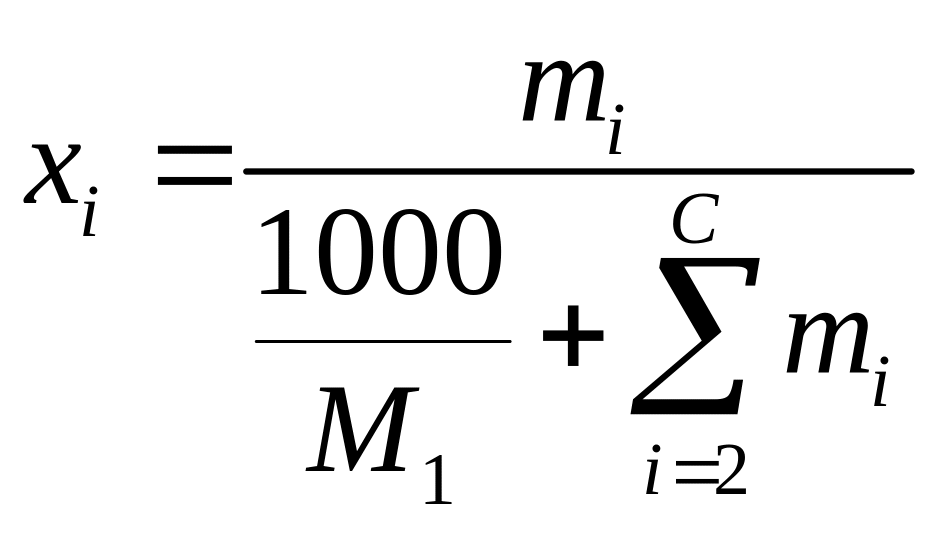 ,
где
ρ(г/см3)
– плотность раствора, Mi
– молярная масса i-го
компонента, C
– число компонентов в растворе.
,
где
ρ(г/см3)
– плотность раствора, Mi
– молярная масса i-го
компонента, C
– число компонентов в растворе.
Раствор называется насыщенным по данному веществу, если в заданных условиях это вещество (твердое, жидкое или газообразное) больше не переходит в раствор. Иначе говоря, система, содержащая нерастворенное вещество и раствор, находится в состоянии равновесия.
При растворении молекулы растворяемого вещества могут образовывать ассоциаты, приводящие к эффективному снижению числа растворенных частиц в растворе. С другой стороны, взаимодействуя с молекулами растворителя, молекулы растворяемого вещества могут распадаться, или диссоциировать. Если при диссоциации образуются заряженные частицы – ионы, то вещество называется электролитом, а диссоциация – электролитической. При диссоциации эффективное количество частиц в растворе увеличивается. Как при ассоциации, так и при диссоциации для описания свойств раствора одной лишь концентрации растворенного вещества недостаточно.
Диссоциацию характеризуют степенью диссоциации α – долей распавшихся частиц относительного полного количества частиц, введенных в раствор. Вещества, полностью диссоциирующие на ионы, называются сильными электролитами, и для них α = 1. Для неэлектролитов α = 0. Промежуточные значения α соответствуют слабым электролитам.
Если при диссоциации молекулы растворенного вещества образуется ν ионов, то полное число частиц в 1 л раствора равно сумме чисел образовавшихся ионов и частиц, не диссоциировавших на ионы: αcν + (1–α)c = c + αc(ν–1). Отношение числа частиц к числу молекул, введенных в раствор, называется изотоническим коэффициентом Вант-Гоффа i:
![]()
