
- •Биохимия
- •Химический состав живых организмов.
- •Химические вещества в живых организмах.
- •Неорганические вещества клетки
- •Функции воды
- •Неорганические соли
- •Роль солей в организме.
- •Органические вещества клетки.
- •Углеводы.
- •Химические свойства моносахаридов. Реакции по карбонильной группе
- •2. Восстановление.
- •Реакции по гидроксильным группам
- •Реакции брожения.
- •Олигосахариды. Полисахариды.
- •Строение дисахаридов.
- •Полисахариды.
- •Крахмал.
- •Амилаза и Амилопектин – две фракции крахмала.
- •Химические свойства полисахаридов:
- •Целлюлоза.
- •Химические свойства целлюлозы:
- •Липиды.
- •Простагландины.
- •Физические свойства липидов.
- •Функции жиров в организме:
- •Нуклеиновые кислоты
- •Биологически важные гетероциклические соединения
- •Кислотно-основные свойства гетероциклов
- •Строение мононуклеотидов
- •Название нуклеозидов и мононуклеотидов
- •Первичная структура днк
- •Вторичная структура днк
- •Структура рнк
- •Белки аминокислотный состав белков
- •Структуры белков первичная
- •Вторичная
- •Третичная
- •Свойства белков электрические
- •Денатурация белка
- •Функции белков в клетке
- •Физические и химические свойства
- •Химические свойства
- •Качественные реакции на белки
- •Биокатализ
- •2 Класс: Трансферазы
- •3 Класс (Гидролазы)
- •4 Класс: Лиазы
- •5 Класс: Изомеразы
- •6 Класс: Лигазы (синтетазы)
- •Номенклатура ферментов
- •Кофакторы
- •Водорастворимые
- •Жирорастворимые
- •I. Коферменты, входящие в состав оксиредуктаз (коферменты дегидрогеназ)
- •I.2.Флавиновые дегидрогеназы
- •I.4. Группа гемма
- •II. Коферменты переноса групп (трансферазы)
- •II.1. Аминотрансферазы.
- •Ацилтрансферазы
- •Основы кинетики ферментативных реакций Зависимость скорости ферментативной реакции от концентрации реагентов
- •Влияние температуры на скорость ферментативных реакций
- •Влияние рН на скорость ферментативной реакции
- •Ингибиторы ферментов
- •Динамическая биохимия
- •Катаболизм Специфические и общие пути катаболизма.
- •Катаболизм углеводов
- •Катаболизм липидов
- •Катаболизм белков
- •Катаболизм аминокислот.
- •Общий путь катаболизма.
- •Цпэ. Тканевое дыхание. Окислительное фосфорилирование.
- •Биосинтезы Биосинтез днк. Репликация.
- •Биосинтез рнк
- •Информационные рнк
- •Рибосомные рнк
- •Трансляция (биосинтез белка)
- •Биосинтез углеводов
- •Биосинтез гликогена
- •Биосинтез жиров
- •Биосинтез жирных кислот.
- •Биосинтез триацилглицеридов
- •Оглавление
Биосинтез гликогена
Значительная часть глюкозы, поступающей в клетки при пищеварении превращается в гликоген – животный крахмал −запасной полисахарид, который используется в интервалах между приёмами пищи. Он сходен по строению с крахмалом. Непосредственным донором глюкозных остатков при синтезе гликогена служит уридиндифосфатглюкоза (УДФ-глюкоза)−продукт взаимодействия глюкозо-1-фосфата и УТФ.
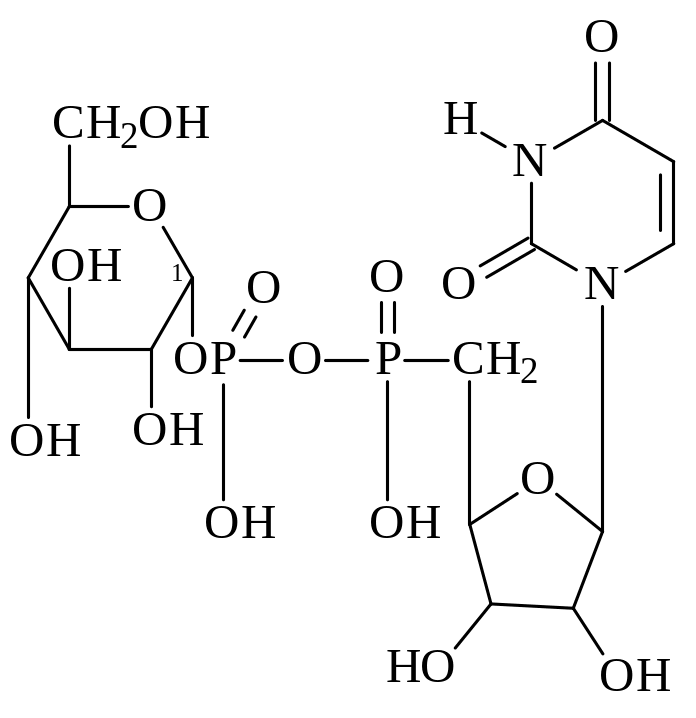
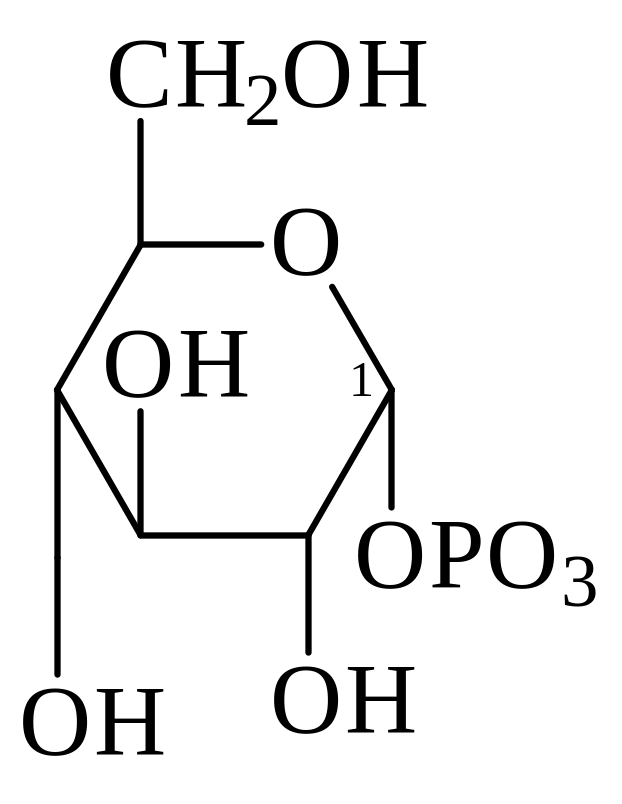
УДФ-глюкоза
глюкозо-1-фосфат
При синтезе гликогена роль акцептора глюкозных остатков выполняют олигосахариды из 2-х и более глюкозных остатков, связанные 1,4-гликозидной связью, или уже имеющиеся молекулы гликогена:
У ДФ-глюкоза + (глюкоза)n УДФ + (глюкоза)n+1
Реакцию катализирует гликогенсинтетаза, при этом образуются 1,4-гликозидные связи в линейных участках молекулы гликоген. Ответвления возникают в результате действия фермента ветвления (амило-1,4-1,6-гликозилтрансферазы). Этот фермент переносит фрагмент из пяти-семи мономеров с конца линейного участка ближе к его середине, который присоединяется 1,6-гликозидной связью. Затем оба конца удлиняются при участии гликогенсинтазы, и на них вновь возникают ветвления.
Таким путем синтезируются огромные молекулы с молекулярной массой от 1млн до 200млн, содержащие до 1 млн глюкозных остатков.
В клетке гликоген находится не в растворённом состоянии, а в виде гранул диаметром 40- 200 нм, включающих одну или несколько молекул.
Необходимость превращения глюкозы в гликоген при запасании энергетического материала обусловлено тем, что накопление легко растворимой глюкозы в клетках могло бы привести к осмотическому шоку и разрушению клеточной мембраны. Запасание гликогена связано с расходом 2-х молекул АТФ на каждую молекулу глюкозы, которая включается в гликоген.
АТФ
Г
 люкоза
люкоза
АДФ
Г люкозо-6-фосфат
Г
УТФ
УДФ
У ДФ-глюкоза
АТФ
Г
АДФ
Гликоген образуется практически во всех клетках организма, однако наибольшая концентрация обнаруживается в печени − от 2 до 6 % и в мышцах − от 0,5 до 2 %. Поскольку общая масса мышц велика, больше всего по массе гликогена содержится в мышцах. Глюкоза, которая депонирована в форме гликогена, освобождается при помощи фермента гликогенфосфорилазы. Голодание в течениеи24 часов приводит к почти полному исчезновению гликогена в клетках печени. Однако при ритмичном питании каждая молекула гликогена может существовать неопределенно много времени.
Биосинтез жиров
Включает в себя биосинтез жирных кислот и триацилглицеридов (собственно, жиров).
Биосинтез жирных кислот.
Биосинтез жирных кислот происходит при высокой концентрации глюкозы в крови в основном в печени и в жировой ткани. В этот период активируется гликолиз, в результате которого образуются субстраты для синтеза жирных кислот: ацетил КоА, АТФ, (НАДФ·Н + Н+) и другие. Основным строительным блоком для биосинтеза жирных кислот служит ацетил КоА, а главным конечным продуктом является пальмитиновая кислота С15Н31СООН.
Другие жирные кислоты образуются, как правило, путём модификации молекулы пальмитиновой кислоты – наращиванием цепи и дегидрированием. В последнем случае образуются непредельные кислоты.
Синтез пальмитиновой кислоты происходит не в митохондриях, где происходит катаболизм жирных кислот, а в цитозоле. Основным ферментом этого биосинтеза служит мультиферментный комплекс пальметилсинтетаза. Так как мембрана митохондрии непроницаема для ацетил КоА, то начальным этапом биосинтеза является перенос ацетил КоА через митохондриальную мембрану с помощью цитратпируватного челночного механизма.
Известно, что первой реакцией цикла Кребса является конденсация ацетил КоА с щавелевоуксусной кислотой (оксалоацетатом) с образованием цитрата (лимонной кислоты). Часть образовавшихся цитрат-ионов не вовлекается в дальнейшие реакции цикла Кребса, а переносятся через митохондриальную мембрану в цитозоль, где в присутствии цитратлиазы и при участии АТФ и HS-KoA вновь образует ацетил-КоА и ЩУК :
Цитрат + HS-KoA + АТФ → Оксалоацетат + Ацетил-КоА + АДФ + Н3РО4
Возвращение оксалоацетата в митохондрии осуществляется с помощью двух посредников − малата и пирувата
Восстановление оксалоацетата в малат в цитозоле является частью малатаспартатного челночного механизма переноса восстановленного (НАД∙Н + Н+) из цитозоля в митохондрии:
Оксалоацетат + НАД∙Н + Н+ ↔ Малат + НАД
Однако образовавшийся малат не переносится с\через мембрану, а сразу окисляется с одновременным декарбоксилированием в пируват:
Малат + НАДФ+ → Пируват + СО2 + НАДФ∙Н + Н+
Все описанные превращения изображены на схеме:
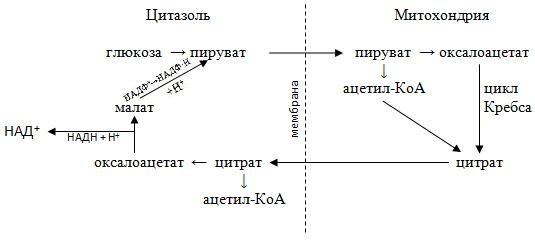
Таким образом, перенос одной молекулы ацетил КоА из митохондрии в цитозоль сопровождается образованием одной молекулы восстановленной формы (НАДФ·Н + Н+), который необходим для многих биосинтезов, а пируват, который дифундирует в митохондрии, затем карбоксилируется с образованием оксалоацетата.
Собственно синтез пальмитиновой кислоты начинается с карбоксилирования ацетил КоА. Эта реакция протекает в присутствии фермента, простетической группой которого является биотин:
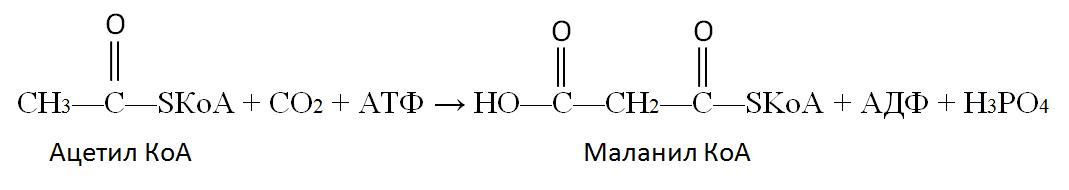
Эта реакция является ключевой в синтезе жирных кислот. Дальнейшие превращения объединяются в циклы по шесть реакций, и в результате завершения каждого цикла углеродная цепь будущей молекулы удлиняется на два углеродных атома.
Рассмотрим реакции, протекающие в первом цикле синтеза жирных кислот.
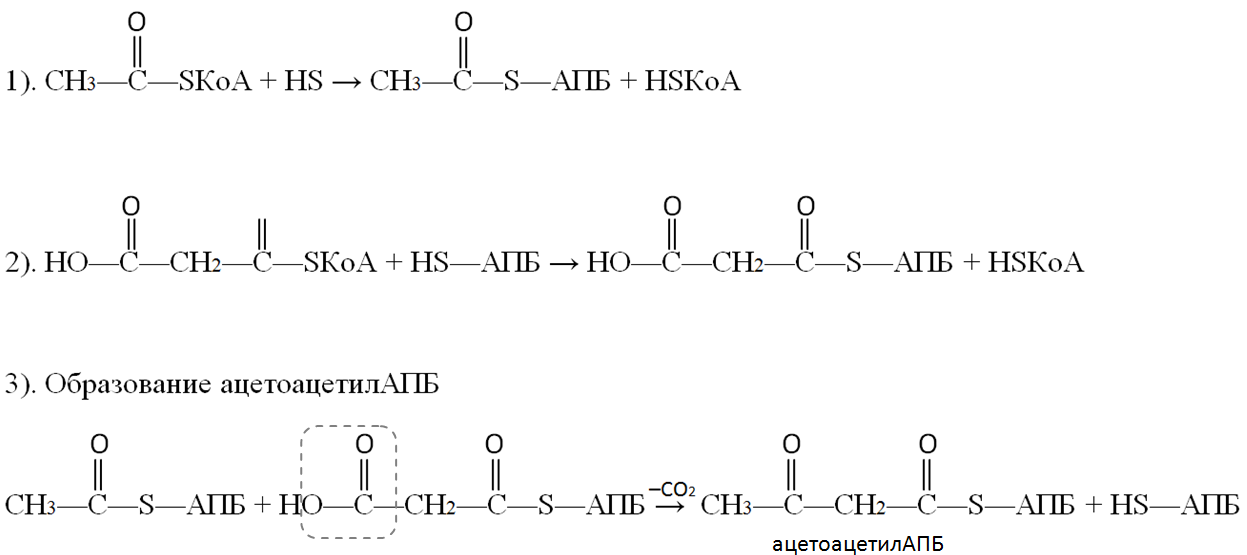
В первых двух реакциях происходит перенос ацетильного и малонильного фрагментов на ацилпереносящий белок (АПБ).
АПБ представляет собой полипептидную цепь, состоящую из 77 аминокислотных остатков и бокового ответвления, повторяющую по существу структуру кофермента А:
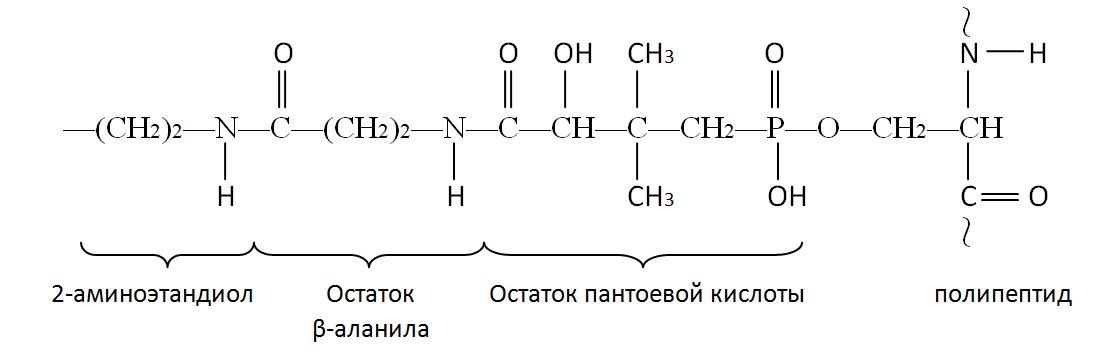
Реакции переноса ацетильного и малонильного фрагментов с ацетил-КоА (1) и малонил-КоА (2) катализируются ацилтрансферазами.
3-ья реакция состоит в образовании ацетоацетил-АПБ из ацетил-АПБ и маонил-АПБ с одновременным декарбоксилированием.
В дальнейшем в три этапа (реакции 4-6) происходит восстановление образовавшегося ацетоацетил-АПБ.
В ходе 4-ой реакции одна из двух карбонильных групп восстанавливается до гидроксильной и образуется дегидроксибутерил-АПБ. Эта реакция является НАДФ–зависимой, т.е. восстановителем служит восстановленная форма НАДФ:
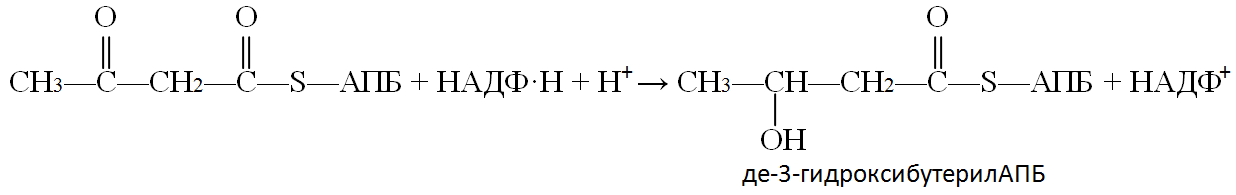
5-ая реакции - реакция дегидратации, ферментом этой реакции является гидроксиацил-АПБ-дегидратаза:
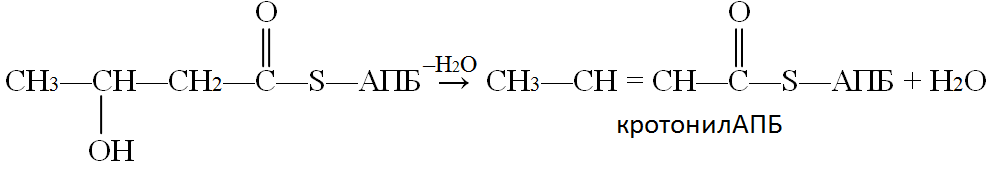
Следующая реакция восстановления (6) – реакция гидрирования – также требует участия НАДФ∙Н + Н+. Катализируется она еноил-АПБ-редуктазой, продуктом реакции являетотся бутирилАПБ:
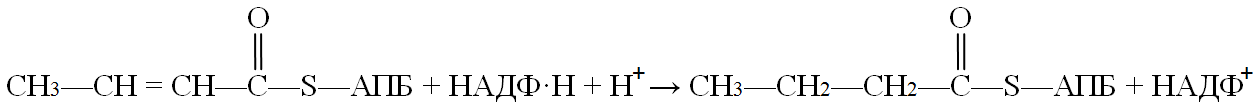
Все реакции цикла элонгации (удлинения) цепи жирных кислот катализируются мультиферментным комплексом. Он состоит из двух полипептидных цепей. Одна из них (субъединица А) включает АПБ, оксоацил-АПБ-синтазу и оксоацил-редуктазу. В составе субъединицы Б находятся 4 других фермента. Согласованная работа мультиферментного комплекса обусловлена наличием в молекуле АПБ большого рычага – гибкой и достаточно длинной цепочки атомов, соединяющей «якорную» HS-группу с полипептидной цепью
Синтез пальмитиновой кислоты включает 7 циклов. Во второй цикл вместо ацетил-АПБ вступает уже бутирил-АПБ (С4-ацил), и в результате образуется каприл-АПБ (С6-ацил) и т.д. (схема):
1-ый цикл: малонил-АПБ + ацетил_АПБ
↓
2-ой цикл: малонил-АПБ + бутирил-АПБ
↓
3-ий цикл: малонил-АПБ + каприл-АПБ
↓
4-ый цикл: малонил-АПБ + С8-ацил-АПБ
↓
5-ый цикл: малонил-АПБ + С10-ацил-АПБ
↓
6-ой цикл: малонил-АПБ + С12-ацил-АПБ
↓
7-ой цикл: малонил-АПБ + С14-ацил-АПБ
↓
пальмитил-АПБ
Суммарное уравнение биосинтеза пальмитиновой кислоты из ацетил-КоА в результате реакций семи циклов записывается следующим образом:
8 ацетил-Коа + 7 АТФ + 14 (НАДФ∙Н + Н+) → пальмитат + 14 НАДФ+
+ 8 НS-КоА + 7 АДФ + 7 Н3РО4
Из пальмитиновой кислоты путем присоединения дополнительно одной или нескольких молекул ацетил-КоА синтезируюся молекулы с более длинными цепями, а путем дегидрирования – ненасыщенные кислоты. «Доработка» молекул пальмитиновой кислоты осуществляется с помощью ферментов эндоплазматической сети, но может проходить и в митохондриях. Дегидрирование насыщенной жирной кислоты происходит параллельно с окислением НАДФ под действием молекулярного кислорода:
С15Н31СОО-S-КоА + НАДФ∙Н + Н+ + О2 →СН3-(СН2)5-СН=СН-(СН2)7-СОО-S-КоА +НАДФ+ + 2 Н2О
Дегидрирование насыщенных жирных кислот происходит в клетках печени и жировой ткани. В организме человека отсутствуют ферменты, позволяющие дегидрировать фрагменты –СН2-СН2-, находящиеся дальше С9, поэтому диеновая линолевая кислота
С18Н32СООН и триеновая линоленовая кислота С18Н30СООН в организме не синтезируются.
