
- •Билет №1
- •Основные законы химии.
- •Закон кратных отношений.
- •Закон эквивалентов
- •Для расчета эквивалента кислоты надо молярную массу разделить на основность.
- •Катализ. Гомологический катализ.
- •Билет №2
- •1. Химическая термодинамика. Основные понятия. Первый закон.
- •Окружающая среда
- •Система
- •2. Растворы. Образование растворов. Способы выражения концентрации растворов.
- •Билет №3
- •1. Закон Гесса. Следствие закона Гесса.
- •2. Растворимость газов в жидкости.
- •Влияние давления
- •Влияние температуры на растворимость газа в жидкости
- •Билет №4
- •1. Расчет абсолютного значения энтропии. Третий закон термодинамики.
- •2. Закон Рауля. Криоскопия и эбуллиоскопия.
- •Билет №5
- •1. Второй закон термодинамики.
- •2 Закон термодинамики.
- •2. Растворы электролитов. Закон разведения Освальда.
- •Билет №6
- •1. Свободная энергия Гиббса, как критерий самопроизвольного течения процесса.
- •2. Закон Авогадро. Следствие закона Авогадро.
- •1 Моль любого газа или пара при н.У. Содержит 6,02*1023 структурных единиц.
- •1 Моль любого газа или пара при н.У. Занимает объем 22,4л.
- •Отношение масс равных объемов различных газов равно отношению их молярных масс и называется относительной плотностью первого газа по второму.
- •Билет №7
- •1. Электрохимия. Уравнение Нернста.
- •2. Закон эквивалентов.
- •Для расчета эквивалента кислоты надо молярную массу разделить на основность.
- •Расчет эквивалентов оснований.
- •3. Расчет эквивалентов солей и окидов.
- •Билет №8
- •1. Химическое равновесие. Принцип Ле Шателье.
- •Разделим переменные и проинтегрируем уравнения изобары Ван Гоффа
- •2. Классификация электродов. Электроды 1, 2 рода.
- •Билет №9
- •1.Влияние температуры на равновесие. Изобара Ван Гоффа.
- •Разделим переменные и проинтегрируем уравнения изобары Ван Гоффа
- •2. Гальванические элементы.
- •Билет №10
- •1. Электролиз. Законы Фарадея.
- •2. Ионное произведение воды, водородный показатель Kw, Ph.
- •Билет №11
- •1. Химическая кинетика. Закон действия масс. Порядок и молекулярность реакций.
- •2. Электролиз. Его практическое применение.
- •Билет №12
- •1. Влияние времени на скорость реакции. Уравнение Арениуса.
- •2. Электрохимическая коррозия.
- •Билет №13
- •1. Аналитический и практический расчета энергии активации.
- •Графический способ.
- •Аналитический способ
- •Билет №14
- •2. Электролиз. Катодное нанесение покрытий и анодное растворение металла.
- •Билет №15
- •1. Газовые и окислительно-восстановительные электроды.
- •2. Свободная энергия Гиббса и направленность процесса.
- •Билет №16
- •1. Химическое равновесие. Закон действия масс. Связь g и Кр.
- •2. Электрохимические способы защиты металла от коррозии.
- •Билет №17
- •1. Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгоффа.
- •2. Электролиз. Законы Фарадея. Выход по току.
Билет №1
-
Основные законы химии.
-
Закон кратных отношений.
если два элемента образуют несколько соединений, то весовые количества одного элемента (кислород), который соединен с одним и тем же количеством другого элемента относятся между собой, как небольшие целые числа.
H2O
2:1 Закон справедлив для соединений с постоянным составом.
H2O2
Для соединений с переменным составом закон не выполняется. ZnO1-x
2) Закон Авогадро.
В равных объемах различных газов и паров при нормальных условиях содержится одинаковое число молекул.
+ =












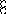
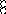
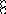
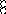
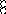

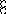
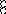
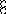
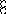



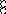
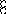
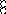
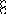
H2 + O2 = 2H2O
-
1 моль любого газа или пара при н.у. содержит 6,02*1023 структурных единиц.
н.у. всегда задаются 273 град. К
p=105Па
-
1 моль любого газа или пара при н.у. занимает объем 22,4л.
-
Отношение масс равных объемов различных газов равно отношению их молярных масс и называется относительной плотностью первого газа по второму.
m1/m2=M1/M2=D
-
Закон эквивалентов
Все вещества реагируют друг с другом в количествах, равных или пропорциональных их химическим эквивалентам.
Химическим эквивалентом называется такое весовое количесвто, которое без остатка взаимодействует с 1г. водорода или же вытесняет такое количество водорода из кислоты.
m1/m2=Э1/Э2
Для расчета эквивалента элемента надо его атомную массу разделить на его валентность.
Определение эквивалента сложных веществ.
1. Экислоты=Mrкислоты/основность
Для расчета эквивалента кислоты надо молярную массу разделить на основность.
-
Расчет эквивалентов оснований.
Эоснования=Mrоснования/кислотность(количество ОН)
-
Расчет эквивалентов солей и окидов.
Эсолей=Mrсоли/оксида/число атомов металла*валентность
Необходимо делить на произведение числа атомов металла и его валентность.
-
Катализ. Гомологический катализ.
Основные положения теории Арениуса.
Чтобы произошло химическое взаимодействие, надо:
-
столкновение молекул
-
энергия молекул должна быть больше или равна энергии активации
-
столкновение должно приходится на функциональную группу.
Недостатки теории.
-
Реальная скорость часто оказывается ниже, чем рассчитанная по теореме Арениуса
-
Она не объясняет явление катализа.
Теория активированного состояния или переходного комплекса.
H2+J2=2HJ
В ходе химической реакции взаимодействия продукты образуются не сразу после столкновения исходных веществ, а сначала образуется промежуточный комплекс. Это реальная молекула, в которой старые связи ещё не совсем разорвались, а новые связи не совсем образованы.
При распаде активированного комплекса образуются продукты реакции. Т.о. энергия активации – это энергия, которая затрачивается на образование активного комплекса.
Катализатор только образует промежуточный комплекс и не меняется в ходе реакции химически (он снижает энергию активации реакции).
Ингибиторы – повышают энергию активации.
Билет №2
1. Химическая термодинамика. Основные понятия. Первый закон.
Термодинамика изучает законы, которые описывают обмен энергии между системой и окружающей средой и, в частности, превращение тепловой энергии в другие формы энергии.
Но не изучает протекание процессов во времени.
Классическая термодинамика изучает макроскопические свойства веществ, а статистическая – микроскопические свойства, от которых зависят макроскопические.
Классическая термодинамика базируется на трех законах, которые установлены опытным путем.
Основные понятия.
Всю Вселенную условно можно разбить на систему, которая подвергнута теоретическому и экспериментальному изучению и окружающую среду. Если система не обменивается с внешней средой ни веществом, ни энергией, то система называется изолированной. Если наоборот, то открытая. Если обмен веществом невозможен, то закрытая.
С A+
Q+
