
- •Билет №1
- •Основные законы химии.
- •Закон кратных отношений.
- •Закон эквивалентов
- •Для расчета эквивалента кислоты надо молярную массу разделить на основность.
- •Катализ. Гомологический катализ.
- •Билет №2
- •1. Химическая термодинамика. Основные понятия. Первый закон.
- •Окружающая среда
- •Система
- •2. Растворы. Образование растворов. Способы выражения концентрации растворов.
- •Билет №3
- •1. Закон Гесса. Следствие закона Гесса.
- •2. Растворимость газов в жидкости.
- •Влияние давления
- •Влияние температуры на растворимость газа в жидкости
- •Билет №4
- •1. Расчет абсолютного значения энтропии. Третий закон термодинамики.
- •2. Закон Рауля. Криоскопия и эбуллиоскопия.
- •Билет №5
- •1. Второй закон термодинамики.
- •2 Закон термодинамики.
- •2. Растворы электролитов. Закон разведения Освальда.
- •Билет №6
- •1. Свободная энергия Гиббса, как критерий самопроизвольного течения процесса.
- •2. Закон Авогадро. Следствие закона Авогадро.
- •1 Моль любого газа или пара при н.У. Содержит 6,02*1023 структурных единиц.
- •1 Моль любого газа или пара при н.У. Занимает объем 22,4л.
- •Отношение масс равных объемов различных газов равно отношению их молярных масс и называется относительной плотностью первого газа по второму.
- •Билет №7
- •1. Электрохимия. Уравнение Нернста.
- •2. Закон эквивалентов.
- •Для расчета эквивалента кислоты надо молярную массу разделить на основность.
- •Расчет эквивалентов оснований.
- •3. Расчет эквивалентов солей и окидов.
- •Билет №8
- •1. Химическое равновесие. Принцип Ле Шателье.
- •Разделим переменные и проинтегрируем уравнения изобары Ван Гоффа
- •2. Классификация электродов. Электроды 1, 2 рода.
- •Билет №9
- •1.Влияние температуры на равновесие. Изобара Ван Гоффа.
- •Разделим переменные и проинтегрируем уравнения изобары Ван Гоффа
- •2. Гальванические элементы.
- •Билет №10
- •1. Электролиз. Законы Фарадея.
- •2. Ионное произведение воды, водородный показатель Kw, Ph.
- •Билет №11
- •1. Химическая кинетика. Закон действия масс. Порядок и молекулярность реакций.
- •2. Электролиз. Его практическое применение.
- •Билет №12
- •1. Влияние времени на скорость реакции. Уравнение Арениуса.
- •2. Электрохимическая коррозия.
- •Билет №13
- •1. Аналитический и практический расчета энергии активации.
- •Графический способ.
- •Аналитический способ
- •Билет №14
- •2. Электролиз. Катодное нанесение покрытий и анодное растворение металла.
- •Билет №15
- •1. Газовые и окислительно-восстановительные электроды.
- •2. Свободная энергия Гиббса и направленность процесса.
- •Билет №16
- •1. Химическое равновесие. Закон действия масс. Связь g и Кр.
- •2. Электрохимические способы защиты металла от коррозии.
- •Билет №17
- •1. Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгоффа.
- •2. Электролиз. Законы Фарадея. Выход по току.
2. Закон Авогадро. Следствие закона Авогадро.
В равных объемах различных газов и паров при нормальных условиях содержится одинаковое число молекул.
+ =













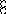















H2 + O2 = 2H2O
-
1 Моль любого газа или пара при н.У. Содержит 6,02*1023 структурных единиц.
н.у. всегда задаются 273 град. К
p=105Па
-
1 Моль любого газа или пара при н.У. Занимает объем 22,4л.
-
Отношение масс равных объемов различных газов равно отношению их молярных масс и называется относительной плотностью первого газа по второму.
m1/m2=M1/M2=D
Билет №7
1. Электрохимия. Уравнение Нернста.
Если любой металл (Al, Fe) опустить в воду, то часть ионов металла с поверхности перейдет в воду.
Me0-2e=Me4+
На поверхности раздела фаз возникает двойной электрический слой, обладающий определенным значением электронного потенциала.
Скорость растворения у разных металлов разная.
Если металл опускать раствор своей соли, то получится следующее:
-
д
 ля
активных металлов (стоящие до водорода)
наблюдается та же картина: пластина
заряжена отрицательно, часть ионов
переходит в воду.
ля
активных металлов (стоящие до водорода)
наблюдается та же картина: пластина
заряжена отрицательно, часть ионов
переходит в воду.
Gраств<0
Энергия гидротации больше, чем работа выхода ионов на поверхности металла.
Zn0-2e=Zn2+
восст. окисл.
-
для металлов за водородом, энергетически более выгоден следующий процесс: ионы металла из раствора внедряются в кристаллическую структуру металла, заряжая его положительно.

Cu2++2e=Cu0
В обоих случаях на границах раздела фаз возникает электронный потенциал. Его величина зависит от:
-
природы металла
-
концентрации раствора
-
температуры
Влияние этих факторов описывается уравнением Нернста:
восстановительную форму одного и того же элемента.
–
статический электронный потенциал
=+(RT/nF)*ln
F –
число фарадея; n – число
электронов, участвующих в токообразующем
процессе [окисл] – концентрация
окислительной формы
[окисл] [восст]

2. Закон эквивалентов.
Все вещества реагируют друг с другом в количествах, равных или пропорциональных их химическим эквивалентам.
Химическим эквивалентом называется такое весовое количесвто, которое без остатка взаимодействует с 1г. водорода или же вытесняет такое количество водорода из кислоты.
m1/m2=Э1/Э2
Для расчета эквивалента элемента надо его атомную массу разделить на его валентность.
Определение эквивалента сложных веществ.
1. Экислоты=Mrкислоты/основность
Для расчета эквивалента кислоты надо молярную массу разделить на основность.
-
Расчет эквивалентов оснований.
Эоснования=Mrоснования/кислотность(количество ОН)
3. Расчет эквивалентов солей и окидов.
Эсолей=Mrсоли/оксида/число атомов металла*валентность
Необходимо делить на произведение числа атомов металла и его валентность.
Билет №8
1. Химическое равновесие. Принцип Ле Шателье.
Рассмотрим гомогенную газообразную реакцию
T=const
a A+bB
dD+eE
A+bB
dD+eE
Константа
равновесия, выраженная через парциальное
давление.
Kp=
Закон действия масс: Кр равна произведению парциального давления продуктов реакций на произведение парциальных давлений исходных веществ, в степенях, равных стехиометрическим коэффициентам.
Для жидкостей и растворов:
СdDСcC СaA
СbB
Константа
равновесия, выраженная через концентрацию.
K p=
p=
Для реакций, протекающих с лева на право К>>1
Если величина G показывает направление процесса, то Кр показывает, как глубоко протекает этот процесс.
G0=-RTlnKp
-G0/RT
Kp=e
Влияние температуры на Кр. Зависимость описывается изобарой Ван Гоффа.
dlnKp/dt=H/RT2
Влияние различных факторов на смещение равновесия описывается принципом Ле Шателье
Если на систему, находящуюся в равновесии извне действует сила, то равновесие смещается в том направлении, которое ослабляет приложенное воздействие. Поэтому при повышении температуры равновесие будет смещаться в сторону эндотермической реакции.
