
- •Биохимия
- •Химический состав живых организмов.
- •Химические вещества в живых организмах.
- •Неорганические вещества клетки
- •Функции воды
- •Неорганические соли
- •Роль солей в организме.
- •Органические вещества клетки.
- •Углеводы.
- •Химические свойства моносахаридов. Реакции по карбонильной группе
- •2. Восстановление.
- •Реакции по гидроксильным группам
- •Реакции брожения.
- •Олигосахариды. Полисахариды.
- •Строение дисахаридов.
- •Полисахариды.
- •Крахмал.
- •Амилаза и Амилопектин – две фракции крахмала.
- •Химические свойства полисахаридов:
- •Целлюлоза.
- •Химические свойства целлюлозы:
- •Липиды.
- •Простагландины.
- •Физические свойства липидов.
- •Функции жиров в организме:
- •Нуклеиновые кислоты
- •Биологически важные гетероциклические соединения
- •Кислотно-основные свойства гетероциклов
- •Строение мононуклеотидов
- •Название нуклеозидов и мононуклеотидов
- •Первичная структура днк
- •Вторичная структура днк
- •Структура рнк
- •Белки аминокислотный состав белков
- •Структуры белков первичная
- •Вторичная
- •Третичная
- •Свойства белков электрические
- •Денатурация белка
- •Функции белков в клетке
- •Физические и химические свойства
- •Химические свойства
- •Качественные реакции на белки
- •Биокатализ
- •2 Класс: Трансферазы
- •3 Класс (Гидролазы)
- •4 Класс: Лиазы
- •5 Класс: Изомеразы
- •6 Класс: Лигазы (синтетазы)
- •Номенклатура ферментов
- •Кофакторы
- •Водорастворимые
- •Жирорастворимые
- •I. Коферменты, входящие в состав оксиредуктаз (коферменты дегидрогеназ)
- •I.2.Флавиновые дегидрогеназы
- •I.4. Группа гемма
- •II. Коферменты переноса групп (трансферазы)
- •II.1. Аминотрансферазы.
- •Ацилтрансферазы
- •Основы кинетики ферментативных реакций Зависимость скорости ферментативной реакции от концентрации реагентов
- •Влияние температуры на скорость ферментативных реакций
- •Влияние рН на скорость ферментативной реакции
- •Ингибиторы ферментов
- •Динамическая биохимия
- •Катаболизм Специфические и общие пути катаболизма.
- •Катаболизм углеводов
- •Катаболизм липидов
- •Катаболизм белков
- •Катаболизм аминокислот.
- •Общий путь катаболизма.
- •Цпэ. Тканевое дыхание. Окислительное фосфорилирование.
- •Биосинтезы Биосинтез днк. Репликация.
- •Биосинтез рнк
- •Информационные рнк
- •Рибосомные рнк
- •Трансляция (биосинтез белка)
- •Биосинтез углеводов
- •Биосинтез гликогена
- •Биосинтез жиров
- •Биосинтез жирных кислот.
- •Биосинтез триацилглицеридов
- •Оглавление
Структуры белков первичная
Первичная структура белка – это число и последовательность аминокислотных (АК) остатков, соединённых друг с другом пептидными связями.
Первые исследования по выяснению аминокислотных последовательностей белков были выполнены в Кембриджском университете Фредериком Сенгером , дважды нобелевским лауреатом (1958,1980) Работал с гормоном инсулина 10 лет. Было установлено, что в молекулу инсулина входит 51 аминокислотных остатков. Молекула состоит из двух полипептидных цепей, соединённых дисульфидными мостиками. В 1954 году нобелевскую премию получил Лайнус Поллинг (1953).. Он выявил, что организм человека состоит из 10 тыс. различных белков. Расшифровал геном человека.
АК последовательность белка строго определена генетическим кодом и определяет его биологические функции. Замена одной АК в молекуле белка может изменить все функции.
Вторичная
Вторичная структура белка представляет собой способ укладки полипептидной цепи в упорядоченную форму за счёт системы водородных связей.
Две формы вторичной структуры:
- спиральная (в пределах одной полипептидной цепи)
- слоисто-складчатая (за счет водородных связей между смежными полипептидными цепями)
Спираль (α-спираль) – сохраняет форму за счёт многочисленных водородных связей между находящимися рядом СО и NН группами.
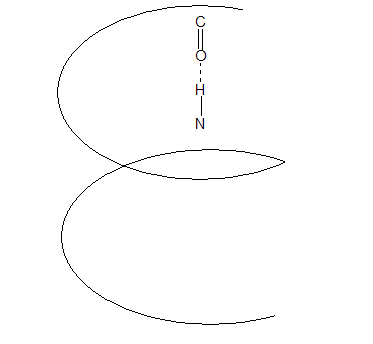
Витки спирали регулярны. В одном витке α-спирали 3, 6 АК-остатка, каждая пептидная группа образована водородной связью, с четвёртой от неё пептидной группой. α-спираль – устойчива.
Белковая молекула может иметь и другой вид – складчатый. В этом случае связываются водородной связью две антипараллельные соседние цепи (против «N» - конца одной полипептидной цепи стоит «С» - конец второй). Водородные связи перпендикулярны цепям и эта конфигурация (β-складчатый слой) прочна на разрыв, гибка (фиброин шёлка, волосы).
Белок коллаген состоит из трёх полипептидных цепей, свитых вместе, которые образуют тройную спираль. Такой белок невозможно растянуть (в сухожилиях, костных тканях). При закручивании полипептидной цепи в спираль радикалы АК- остатков направлены наружу от цепи и они могут взаимодействовать между собой, формируя третичную структуру – глобулу или фибриллу.
Третичная
Третичная структура - ещё более высокая организация белковых молекул. Она даёт представление об объёмной форме и взаимном расположении участков белковой молекулы. Глобула – это свернувшаяся в клубок спираль, которая поддерживается за счёт водородных, ионных, ковалентных (дисульфидных) связей, гидрофобных взаимодействий между боковыми неполярными радикалами АК. Спирали могут компактно укладываться в пучки, которые также удерживаются вышеперечисленными связями
 С=О
Н—N водородная связь
С=О
Н—N водородная связь
—S ———————— S— ковалентная связь

 —NH3+
–O—C—
ионная связь
—NH3+
–O—C—
ионная связь
О
— R R — гидрофобное взаимодействие за счет сил Ван-дер-Ваальса.
В количественном отношении при формировании третичной структуры более важны гидрофобные взаимодействия. Белки сворачиваются таким образом, чтобы его гидрофобные боковые цепи были скрыты от взаимодействия с водой, а гидрофильные – высовывались наружу.
ЧЕТВЕРТИЧНАЯ (характерна для для глобулярных белков)
Образуется при взаимодействии нескольких белковых глобул, образующих субъединицу за счёт водородных и ионных связей.
Субъединица Гемоглобина состоит из четырёх отдельных полипептидных цепей двух типов : двух α-цепей и двух β-цепей. Две α-цепи содержат по 141 АК-остатку, β-цепи содержат по 146 АК-остатков.
Молекулярная формула гемоглобина С3032Н4816О172N780S8Fe4
