
- •Биохимия
- •Химический состав живых организмов.
- •Химические вещества в живых организмах.
- •Неорганические вещества клетки
- •Функции воды
- •Неорганические соли
- •Роль солей в организме.
- •Органические вещества клетки.
- •Углеводы.
- •Химические свойства моносахаридов. Реакции по карбонильной группе
- •2. Восстановление.
- •Реакции по гидроксильным группам
- •Реакции брожения.
- •Олигосахариды. Полисахариды.
- •Строение дисахаридов.
- •Полисахариды.
- •Крахмал.
- •Амилаза и Амилопектин – две фракции крахмала.
- •Химические свойства полисахаридов:
- •Целлюлоза.
- •Химические свойства целлюлозы:
- •Липиды.
- •Простагландины.
- •Физические свойства липидов.
- •Функции жиров в организме:
- •Нуклеиновые кислоты
- •Биологически важные гетероциклические соединения
- •Кислотно-основные свойства гетероциклов
- •Строение мононуклеотидов
- •Название нуклеозидов и мононуклеотидов
- •Первичная структура днк
- •Вторичная структура днк
- •Структура рнк
- •Белки аминокислотный состав белков
- •Структуры белков первичная
- •Вторичная
- •Третичная
- •Свойства белков электрические
- •Денатурация белка
- •Функции белков в клетке
- •Физические и химические свойства
- •Химические свойства
- •Качественные реакции на белки
- •Биокатализ
- •2 Класс: Трансферазы
- •3 Класс (Гидролазы)
- •4 Класс: Лиазы
- •5 Класс: Изомеразы
- •6 Класс: Лигазы (синтетазы)
- •Номенклатура ферментов
- •Кофакторы
- •Водорастворимые
- •Жирорастворимые
- •I. Коферменты, входящие в состав оксиредуктаз (коферменты дегидрогеназ)
- •I.2.Флавиновые дегидрогеназы
- •I.4. Группа гемма
- •II. Коферменты переноса групп (трансферазы)
- •II.1. Аминотрансферазы.
- •Ацилтрансферазы
- •Основы кинетики ферментативных реакций Зависимость скорости ферментативной реакции от концентрации реагентов
- •Влияние температуры на скорость ферментативных реакций
- •Влияние рН на скорость ферментативной реакции
- •Ингибиторы ферментов
- •Динамическая биохимия
- •Катаболизм Специфические и общие пути катаболизма.
- •Катаболизм углеводов
- •Катаболизм липидов
- •Катаболизм белков
- •Катаболизм аминокислот.
- •Общий путь катаболизма.
- •Цпэ. Тканевое дыхание. Окислительное фосфорилирование.
- •Биосинтезы Биосинтез днк. Репликация.
- •Биосинтез рнк
- •Информационные рнк
- •Рибосомные рнк
- •Трансляция (биосинтез белка)
- •Биосинтез углеводов
- •Биосинтез гликогена
- •Биосинтез жиров
- •Биосинтез жирных кислот.
- •Биосинтез триацилглицеридов
- •Оглавление
Трансляция (биосинтез белка)
Схема синтеза белка на рибосомах
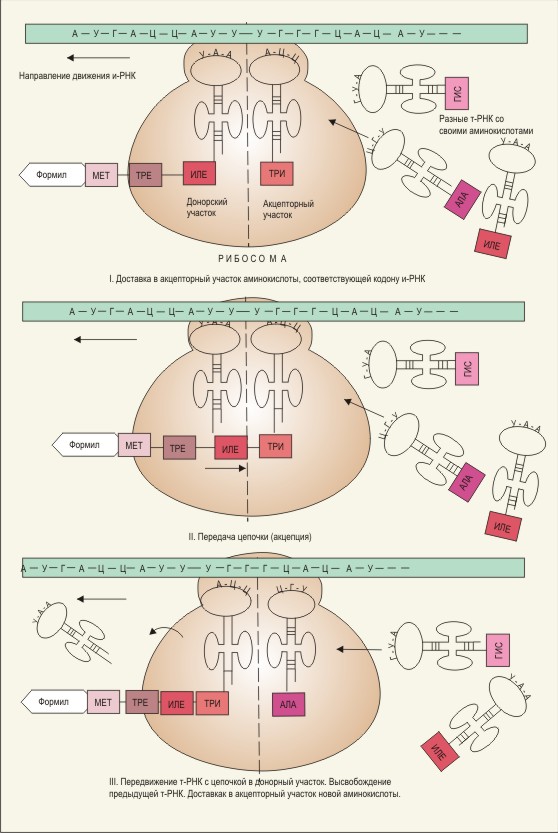
Трансляцией (от слова «перевод») называется синтез полипептидных цепей белка по матрице иРНК. Синтез иРНК, которая несет к рибосомам сведенья о первичной структуре белка, происходит в ядре клеток. Затем иРНК, пройдя через поры ядерной оболочки, направляется к рибосомам, где и происходит расшифровка генетической информации (перевод с языка нуклеотидов на язык аминокислот).
Функция рибосомы заключается в том, чтобы удержать в нужном положении иРНК и комплекс тРНК с аминокислотой до тех пор, пока между соседними аминокислотами не образуется пептидная связь. При этом малая часть рибосомы фиксирует положение иРНК и тРНК, а большая – катализирует образование пептидной связи. Таким образом, на рибосоме имеются 3 различных участка: один для иРНК и два – для тРНК. Из двух последних один участок донорный Р-участок (пептидил-тРНК-связывающий), который держит молекулу тРНК, присоединенную к растущему концу полипептидной цепи, а другой – акцепторный А-участок (аминоацил-тРНК-связывающий), с которым соединяется только что прибывшая тРНК с аминокислотой.
Как и в других реакциях полимеризации, протекающих по цепному механизму, в биосинтезе белков можно выделить три стадии: инициирование, рост цепи и обрыв цепи. Как показывает генетический код, существует только один кодон инициирования AUG, кодирующий начало полипептидной цепи с метионина. начала цепи.
Цепь начинается не с самого начала иРНК, а после какого-то участка переменной длины, потому что инициирующий кодон часто кодирует реакцию не со свободным метионином, а с формил-метионином, специально этерифицированным для инициирования иРНК, которая несет антикодон.
Интересно, что аминогруппа метонина, которая становится N-концевой группой белка, защищена в виде амида так же, как защищается аминогруппа от вступления в реакцию, если эта реакция проводится в пробирке.
Таким образом, на стадии инициирования иРНК, N-формилметионил-тРНК и рибосома связываются между собой. Это происходит в следующей последовательности:
сначала иРНК, выйдя в цитозоль, прикрепляется к малой субчастице рибосомы с помощью ионов магния; затем к ней, к ее стартовому кодону АUG присоединяется первая (инициаторная) тРНК, несущая метионин, и только после этого к ним присоединяется большая субъединица рибосомы, на которой теперь может идти синтез белка (для включения метионина во внутренние участки полипептидной цепи используются другие тРНК).
Поскольку рост белковой молекулы – это процесс удлинения (элонгации) белковой цепи за счет образования пептидных связей между аминокислотами, то эта реакция должна повторяться столько раз, сколько аминокислотных остатков входит в состав белковой молекулы.
Таким образом, синтез любого белка, то есть стадию роста цепи, можно представить в виде циклов, каждый из которых делят на три этапа:
Присоединение комплекса «аа-тРНК» к свободному участку рибосомы (А-участок) за счет спаривания оснований антикодона тРНК с основаниями кодона иРНК.
Образование пептидной связи между С-концом (карбоксильной группой) полипептидной цепи и аминогруппой аминокислоты, присоединенной к молекуле тРНК, находящейся на А-участке.
Передвижение рибосомы вдоль молекулы иРНК на три нуклеотида в направлении 51 – 31. Этот процесс называется транслокацией, при котором тРНК, к которой теперь присоединен растущий белок перемещается вместе с кодоном иРНК в донорный участок (Р-участок), освобождая тРНК-1 и акцепторный участок для новой тРНК-2.
На новую тРНК-2, связанную с аминокислотой, которая шифруется очередным кодоном на иРНК, переносится с донорного участка оторвавшаяся полипептидная цепь, которая удлиняется еще на одно звено. Каждая новая аминокислота, входя в цепь, присоединяется к С-концу белковой цепи. Этим биосинтез белков отличается от синтеза белков в лаборатории, когда белковая цепь удлиняется по N-концевой группе.
Обрыв цепи в реакции синтеза белка происходит в тот момент, когда в него включаются один из трех терминирующих кодонов. Это своеобразный знак препинания между генами. Дело в том, что не существует антикодонов, комплементарных нуклеотидам знаков препинания. Полипептидная цепь, оторвавшаяся в донорном участке, в этом случае уже ни к чему не присоединяется в акцепторном участке и покидает рибосому. Затем этерифицированная на конце длинная белковая цепь гидролизуется до кислоты, а инициирующий N-формилметионин удаляется. Рибосомы, иРНК и Трнк диссоциируют и готовы вновь соединиться для нового синтеза. Высокая слаженность всех «служб комбината» по по производству белков позволяет в течение нескольких секунд синтезировать полипептидные цепи, состоящие из сотен аминокислот.
Для увеличения производства белков иРНК часто присоединяется не к одной, а к нескольким рибосомам. Такая структура – одна иРНК и несколько рибосом – называется полисомой. На каждой рибосоме этом, похожем на нитку бус конвейере, синтезируются одинаковые белки.
Итак, весь процесс трансляции (синтеза полипептидной цепи на иРНК) можно разделить на следующие этапы:
Присоединение иРНК к рибосоме.
Активация аминокислоты и присоединение ее к тРНК с образованием комплекса (аминоацил-тРНК).
Транспорт этого комплекса к рибосоме и инициация синтеза полипептидной цепи.
Удлинение (элонгация) полипептидной цепи.
Окончание роста полипептидной цепи (терминация) и освобождение белковой молекулы от рибосомы.
